

Верный ответ: 3434
Нам необходимо подобрать условия, при которых равновесие сместится вправо, в сторону прямой реакции (в сторону продуктов реакции).
А) при увеличении температуры равновесие смещается в сторону эндотермической реакции (вправо); слева 1 газ, справа 3 газа - в сторону прямой реакции равновесие сместится при уменьшении давления (в сторону больших газов)
Б) при уменьшении температуры равновесие смещается в сторону экзотермической реакции (вправо); слева 3 газа, справа 2 газа - в сторону прямой реакции равновесие сместится при увеличении давления (в сторону меньших газов)
В) при увеличении температуры равновесие смещается в сторону эндотермической реакции (вправо); слева 0 газов, справа 1 газ - в сторону прямой реакции равновесие сместится при уменьшении давления (в сторону больших газов)
Г) при уменьшении температуры равновесие смещается в сторону экзотермической реакции (вправо); слева 2 газа, справа 1 газ - в сторону прямой реакции равновесие сместится при увеличении давления (в сторону меньших газов)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7925.
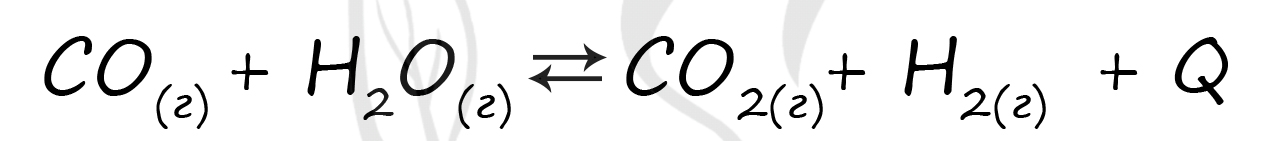
Верный ответ: 1223
А) При увеличении концентрации вещества система стремится противодействовать такому изменению: при добавлении веществ в левую часть равновесие смещается вправо, в сторону прямой реакции (в сторону продуктов реакции - 1), и наоборот.
Б) При увеличении концентрации вещества система стремится противодействовать такому изменению: при добавлении веществ в правую часть равновесие смещается влево, в сторону обратной реакции (в сторону исходных веществ - 2), и наоборот.
В) Повышение температуры (нагревание) смещает равновесие в сторону эндотермической реакции. В данном случае - влево, в сторону обратной реакции (в сторону исходных веществ - 2).
Г) Для успешного решения этого пункта следует посчитать количество газов в левой и правой частях реакции. При уменьшении давления равновесие смещается в ту часть реакции, где газов больше. Газов слева - 2, справа - 2: из-за одинакового количества газов равновесие практически не смещается (3)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7890.
Верный ответ: 2313
При уменьшении давления равновесие смещается в сторону БОЛЬШИХ газов. В каждой реакции ищем ту часть уравнения, в которой газов БОЛЬШЕ.
А) слева 0 газов, справа 0 газов: изменение давления в таком случае не оказывает влияния на равновесие (2)
Б) слева 3 газа, справа 2 газа: при уменьшении давления равновесие сместится в сторону больших газов - влево (3)
В) слева 1 газ, справа 2 газа: при уменьшении давления равновесие сместится в сторону больших газов - вправо (1)
Г) слева 2 газа, справа 1 газ: при уменьшении давления равновесие сместится в сторону больших газов - влево (3)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7855.

Верный ответ: 2231
А) При увеличении концентрации вещества система стремится противодействовать такому изменению: при добавлении веществ в правую часть равновесие смещается влево, в сторону обратной реакции (в сторону исходных веществ - 2), и наоборот.
Б) Максимально хитро! :) Карбонат натрия вступит в реакцию с уксусной кислотой (2СН3СООН + Na2CO3 = 2CH3COONa + H2O + CO2), фактически изымая уксусную кислоту из системы. Поэтому данный пункт следовало бы переписать так: снижение концентрации уксусной кислоты.
При уменьшении концентрации вещества система стремится противодействовать такому изменению: при уменьшении концентрации веществ в левой части равновесие смещается влево, в сторону обратной реакции (в сторону исходных веществ - 2) - смещается ТУДА, ОТКУДА берем
В) Для успешного решения этого пункта следует посчитать количество газов в левой и правой частях реакции. При повышении давления равновесие смещается в ту часть реакции, где газов меньше. Газов слева - 0, справа - 0: из-за одинакового количества газов равновесие практически не смещается (3)
Г) При увеличении концентрации вещества система стремится противодействовать такому изменению: при добавлении веществ в левую часть равновесие смещается вправо, в сторону прямой реакции (в сторону продуктов реакции - 1), и наоборот.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7820.
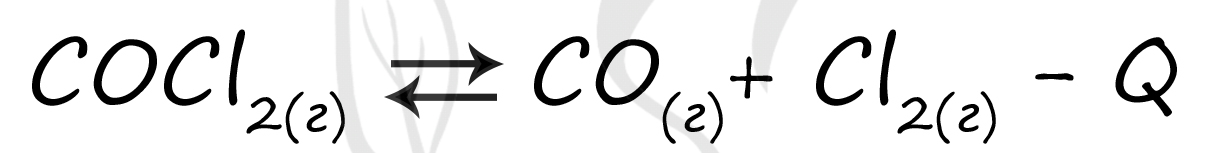
Верный ответ: 2331
А) Использование катализатора ускоряет как прямую, так и обратную реакцию, поэтому равновесие практически не смещается (2)
Б) Повышение температуры (нагревание) смещает равновесие в сторону эндотермической реакции. В данном случае - вправо, в сторону прямой реакции (в сторону продуктов реакции - 3).
В) Для успешного решения этого пункта следует посчитать количество газов в левой и правой частях реакции. При уменьшении давления равновесие смещается в ту часть реакции, где газов больше. Газов слева - 1, справа - 2: равновесие при понижении давления смещается вправо, в сторону прямой реакции (в сторону продуктов реакции - 3)
Г) При увеличении концентрации вещества система стремится противодействовать такому изменению: при добавлении веществ в правую часть равновесие смещается влево, в сторону обратной реакции (в сторону исходных веществ - 1), и наоборот.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7785.