

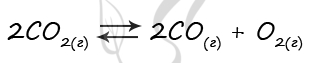
Верный ответ: 56
Таблица (по условиям задания)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7452.
1) Соотношение атомов углерода
ω(C) = 100 - 12,19 = 87,81
x : y = (87,81 / 12) : (12,19 / 1) = 7,3 : 12,19 = 0,6 : 1
Установим молекулярную формулу
0,6 : 1 = 6 : 10
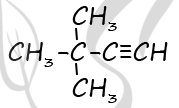
Молекулярная формула - C6H10
2) Структурная формула
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7446.
1) Уравнение реакции
СuSO4 + Fe = FeSO4 + Cu
2) Рассчитаем массу сульфата меди(II) в исходном растворе
n(СuSO4) = n(Сu) = n(Fe)
Чтобы найти эти количества вещества, рассчитаем массу СuSO4 в исходном растворе:
m(СuSO4)исх = 0,3 • 1,175 • 63,5 = 22,4 г.
3) После реакции количество вещества (по условию задачи), а следовательно, и масса CuSO4 уменьшились вдвое. Отсюда m(СuSO4)ост. = 11,2 г.
4) Вычислим количество вещества сульфата меди(II), израсходованного в реакции, изменение массы пластинки
n(СuSO4) = m/М = 11,2/160 = 0,07 моль.
Изменение массы пластинки составляет:
m(Сu) - m(Fe) = n•(M(Cu) - M(Fe)) = 0,07 • 8 = 0,56 г.
4) Вычислим массу пластинки после реакции: 7 + 0,56 = 7,56 г.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7445.
Верный ответ: 80
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7438.
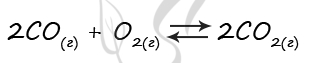
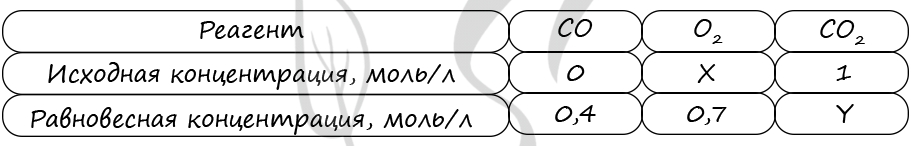
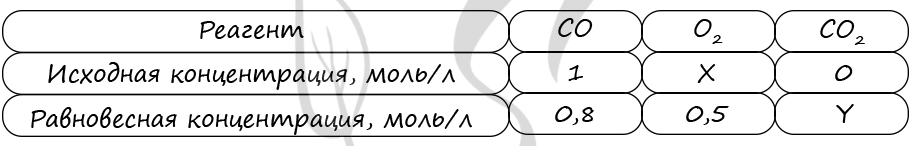
Верный ответ: 52
Таблица (по условиям задания)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7417.