

1) Уравнение реакции
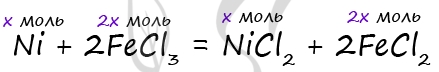
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7375.
Верный ответ: 41,25
Найдем массу соли, которая присутствует в исходном растворе:
m(р-ра соли) = m · w = 500 мл · 1.10 г/мл = 550 г
m(соли) = 550 · 0.14 = 77 грамм

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7368.

Верный ответ: 61
Таблица (по условию задания)

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7347.
1) Найдем количество вещества продуктов сгорания, массу и количество вещества кислорода:
n(CO2) = 6,72 / 22,4 = 0,3 моль
n(C) = n(CO2) = 0,3 моль
n(H2O) = 6,3 / 18 = 0,35 моль
n(H) = 2n(H2O) = 0,35 ⋅ 2 = 0,7 моль
m(C + H) = 0,3 ⋅ 12 + 0,7 ⋅ 1 = 4,3 г
m(O) = 5,1 - 4,3 = 0,8 г
n(O) = 0,8 / 16 = 0,05 моль
Соотношение C : H : O = 0,3 : 0,7 : 0,05 = 6 : 14 : 1
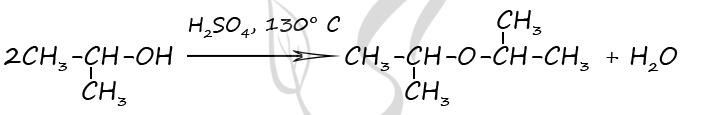
Простейшая формула C6H14O
2) Проведена структура формула вещества
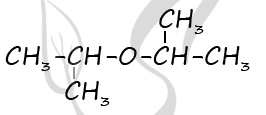
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7341.
1) Уравнение реакции
Zn + СdSO4 = ZnSO4 + Сd
2) Вычислим разницу изначальной и конечной массы пластинки
Δm = 0,094 • 60 = 5,64 г.
3) Обозначим через x количество вещества каждого из компонентов, вступивших в реакцию. В таком случае
Δm = M(Cd) • x - M(Zn) • x = 112x - 65x = 5,64 г
x = 0,12 моль
4) Вычислим массу кадмия, выделившегося на пластинке
m(Cd) = M(Cd) • 0,12 = 112 • 0,12 = 13,44 г.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7340.