

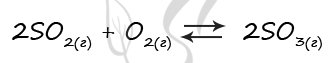
Верный ответ: 41
Таблица (по условиям задания)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7277.
1) Формула вещества - CxHy
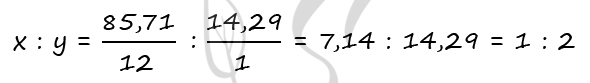
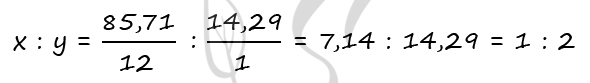
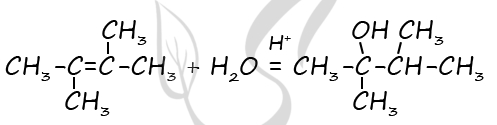
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7271.
1) Уравнения реакций
Na2S + 2H2O = 2NaOH + H2 + S
4NaOH + ZnSO4 = Na2[Zn(OH)4] + Na2SO4
2) Рассчитаем количество вещества гидроксида натрия и сульфата цинка
m(Na2S) = 100 ⋅ 0,078 = 7,8 г
n(Na2S) = 7,8 : 78 = 0,1 моль
n(NaOH) = 2n(Na2S) = 0,2 моль
n(ZnSO4) = n(ZnSO4⋅7H2O) = 5,74 : 287 = 0,02 моль
3) Очевидно, что гидроксид натрия в большом избытке, поэтому вторая реакция протекает с образованием комплексной соли. Максимальная масса осадка выпадет при нейтрализации остатка гидроксида натрия и частичном разрушении комплекса:
NaOH + HCl = NaCl + H2O
Na2[Zn(OH)4] + 2HCl = 2NaCl + Zn(OH)2 + 2H2O
n(NaOHост.) = 0,2 - 0,02 ⋅ 4 = 0,12 моль
n(Na2[Zn(OH)4]) = n(ZnSO4) = 0,02 моль
4) Вычислим массу 20%-го раствора соляной кислоты
n(HCl) = 2n(Na2[Zn(OH)4]) + n(NaOHост.) = 0,04 + 0,12 = 0,16 моль
m(HCl) = 0,16 ⋅ 36,5 = 5,84 г
mр-ра(HCl) = 5,84 : 0,2 = 29,2 г
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7270.
Верный ответ: 810
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7263.
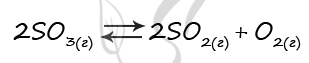
Верный ответ: 52
Таблица (по условиям задания)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7242.