

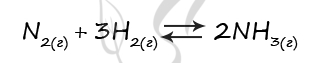
Верный ответ: 43
Таблица (по условиям задания)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6927.
1) Соотношение атомов в составе соли составит:
C : H : N : Br = 28,46/12 : 2,77/11 : 5,53/14 : 63,24/80 = 2,317 : 2,77 : 0,395 : 0,79 = 6 : 7 : 1 : 2
Молекулярная формула соли: C6H7NBr2
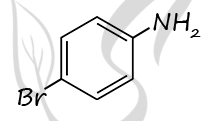
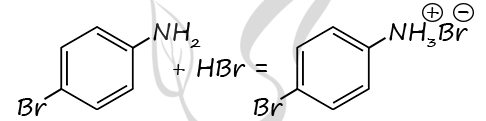
Молекулярная форма вещества А: C6H6NBr
2) Структурная формула
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6921.
1) Уравнения реакций
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
2NaOH + SO2 = Na2SO3 + H2O
2) Вычислим теоретическое количество газа
n(Cu) = m : M = 12,8 : 64 = 0,2 моль
nтеор.(SO2) = n(Cu) = 0,2 моль
3) Вычислим практическое количество газа
mнасыщ. р-ра = 83,16 - 1,26 = 81,9 г
В 130 г р-ра - 30 г соли
В 81,9 г р-ра - х г соли
х = 30 · 81,9 : 130 = 18,9 г
mобщ.(Na2SO3) = 18,9 + 1,26 = 20,16 г
n(Na2SO3) = m : M = 20,16 : 126 = 0,16 моль
nпракт.(SO2) = n(Na2SO3) = 0,16 моль
4) Вычислим выход
η = nпракт.(SO2) : nтеор.(SO2) · 100% = 0,16 : 0,2 · 100% = 80%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6920.
Верный ответ: 133,3
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6913.
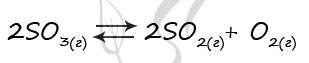
Верный ответ: 11
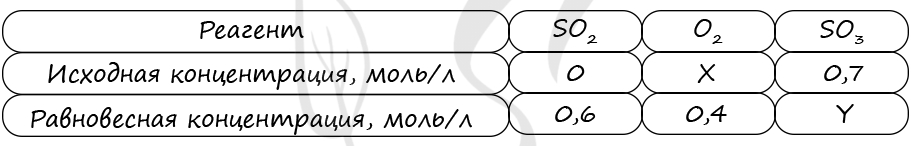
Таблица (по условиям задания)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6892.