

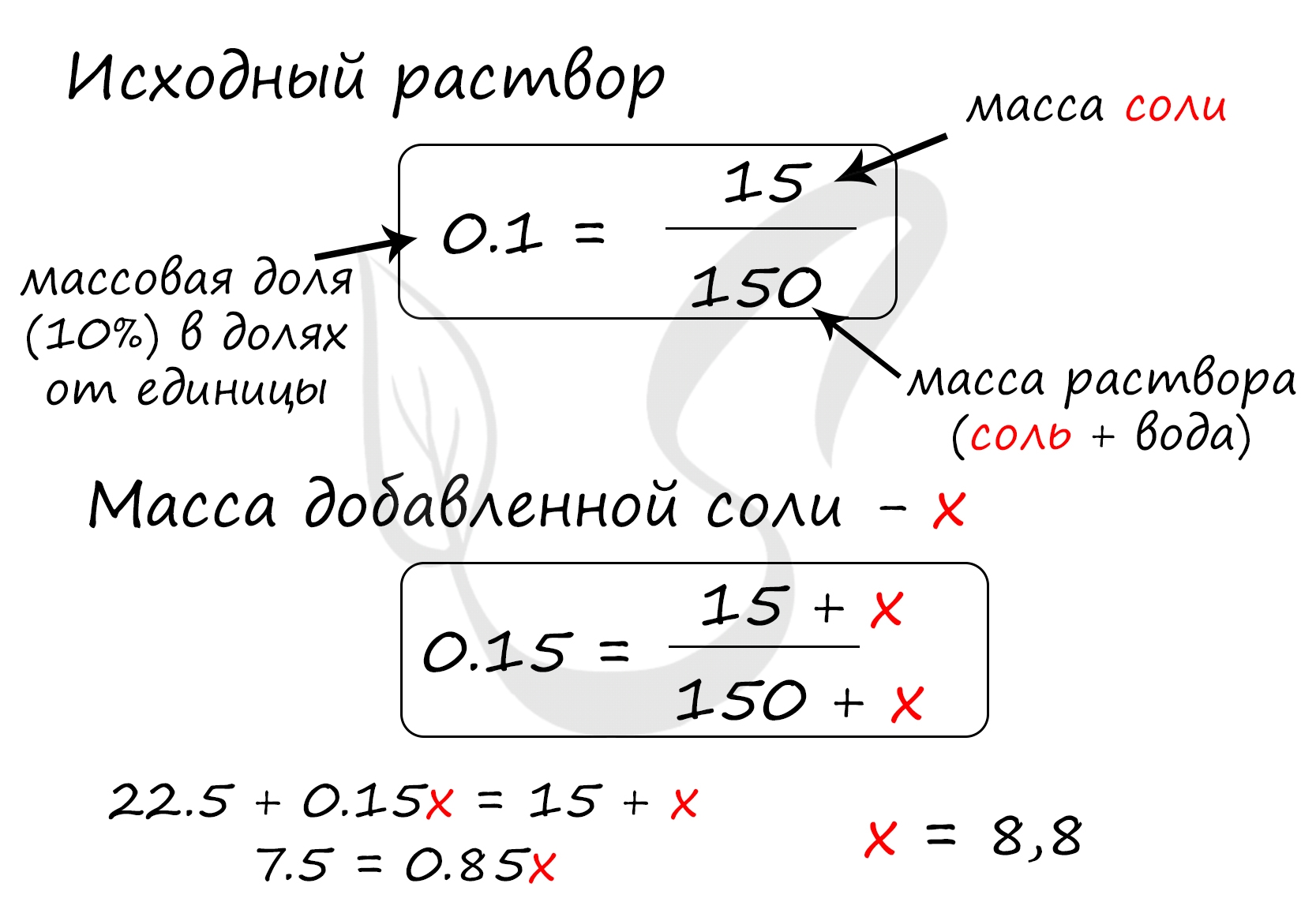
Верный ответ: 8,8
Найдем массу соли, которая присутствует в исходном растворе:
m(соли) = 150 · 0.1 = 15 грамм
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6808.
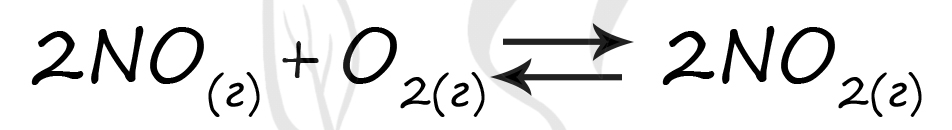
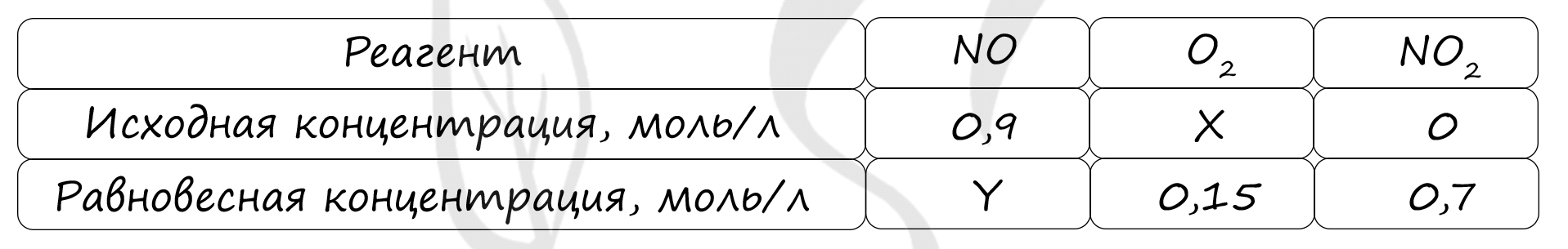
Верный ответ: 52
Таблица (по условиям задания)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6787.
1) Записано уравнение реакции и найдена молярная масса спирта:
CnH2n(OH)2 + 2Na = CnH2n(ONa)2 + H2↑
n(H2) = 8,96 : 22,4 = 0,4 моль
n(CnH2n(OH)2) = n(H2) = 0,4 моль
M(CnH2n(OH)2) = 30,4 : 0,4 = 76 г/моль
Определена молекулярная формула вещества:
M(CnH2n(OH)2) = 12n + 2n + 34 = 76 г/моль
14n + 34 = 76
14n = 42
n = 3
Молекулярная формула: C3H6(OH)2
2) Структурная формула: HO-CH2-CH2-CH2-OH
3) Уравнение реакции вещества с натрием:
HO-CH2-CH2-CH2-OH + 2Na = NaO-CH2-CH2-CH2-ONa + H2↑
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6781.
1) Запишем реакцию
2AgNO3 + H2S = Ag2S↓ + 2HNO3
2) Определим массу раствора и массу растворенного нитрата серебра после охлаждения

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6780.
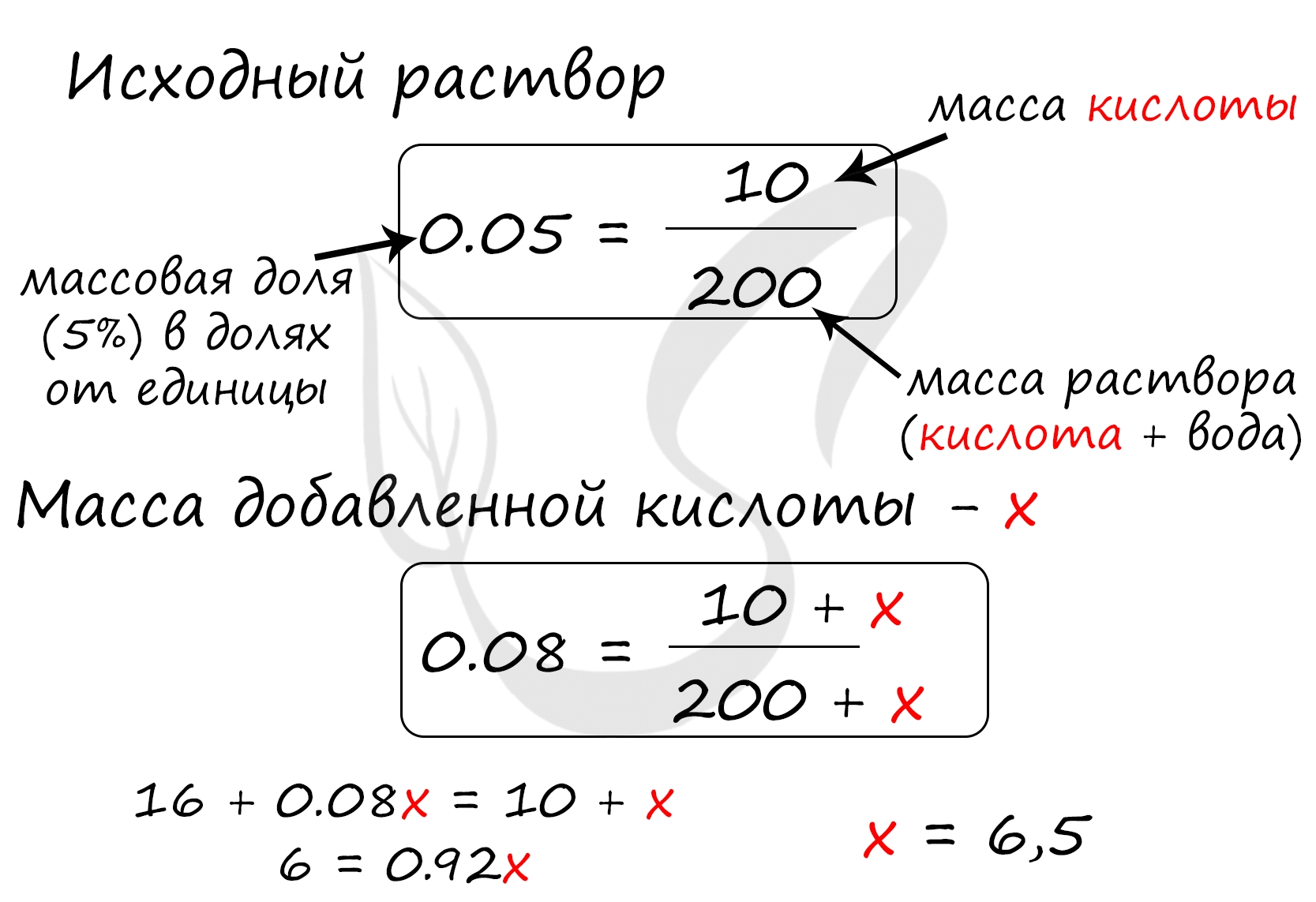
Верный ответ: 6,5
Найдем массу щавелевой кислоты, которая присутствует в исходном растворе:
m(кислоты) = 200 · 0.05 = 10 грамм
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6773.