

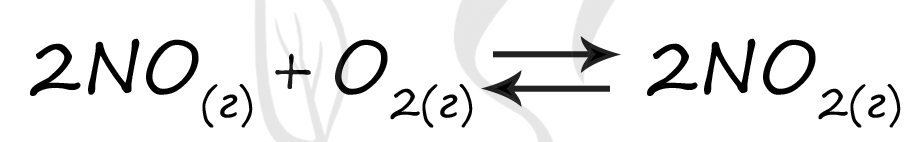
Верный ответ: 66
Таблица (по условиям задания)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7802.
1) Вычислим массовую долю водорода в веществе, и соотношение атомов углерода и водорода
ω(H) = 100 - 87,81 = 12,19
n(C) = ω(H) / M(H) = 87,81 / 12 = 7,3
n(H) = ω(C) / M(C) = 12,19 / 1 = 12,19
Получилось соотношение x : y = 7,3 : 12,19 (делим на наименьшее - 7,3) = 1 : 1.6
Такого вещества нет, включаем химическое мышление. Соотношение 1 к 1.6 то же самое, что 3 к 5.
Однако вещества C3H5 также не существует, поскольку количество атомов водорода должно быть четным. Выход - домножить на два!)
x : y = 3 : 5 (умножаем на 2)
x : y = 6 : 10
Молекулярная формула - C6H10
2) Структурная формула вещества

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7796.
1) Уравнения реакций
10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O (1)
Fe2(SO4)3 + 6NaOH = 2Fe(OH)3↓ + 3Na2SO4 (2)
MnSO4 + 2NaOH = Mn(OH)2↓ + Na2SO4 (3)
2) Вычислим массу исходного сульфата железа (III)
m(KMnO4) = 126,4 ⋅ 0,05 = 6,32 г
n(KMnO4) = 6,32 : 158 = 0,04 моль
n(FeSO4)исх = 5n(KMnO4) = 5 ⋅ 0,04 = 0,2 (по уравнению 1)

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7795.
Верный ответ: 18,5
Вычислим массы первого и второго растворов:
m(р-ра)1 = 45 + 15 = 60 г
m(р-ра)2 = 65 + 10 = 75 г

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7788.
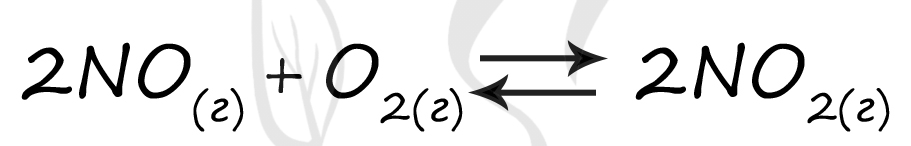
Верный ответ: 41
Таблица (по условиям)
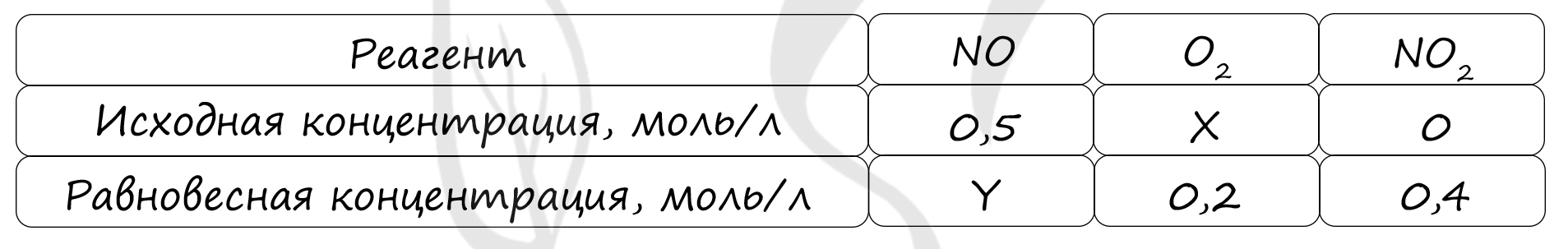
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7767.