

1) Уравнения реакций
Ca + 2HCl = CaCl2 + H2↑ (1)
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ (2)
(?) 2NaOH + CO2 = Na2CO3 + H2O (3)
(?) CO2 + NaOH = NaHCO3 (4)
2) Запишем формулу массы раствора после реакций 1 и 2
m(р-ра после реакций 1 и 2) = m(Ca) + m(CaCO3) + m(HCl)р-ра - m(H2) - m(CO2)
3) Примем n(Ca) = x моль, n(CaCO3) = y моль
m(Ca) = 40x (г)
m(CaCO3) = 100y (г)
n(Ca) = n(H2)по ур-нию 1 = x моль; m(H2) = 2x (г)
n(CaCO3) = n(CO2)по ур-нию 2 = y моль; m(CO2) = 44y (г)
Подставим все найденные значения в формулу массы раствора, записанную в пункте 2
330 = 40x + 100y + 300 - 2x - 44y
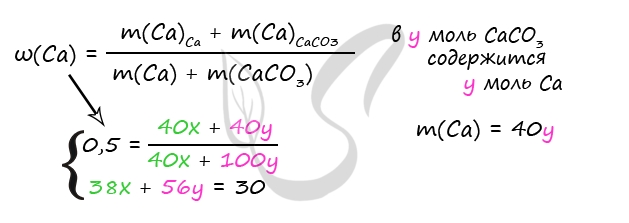
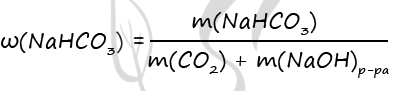
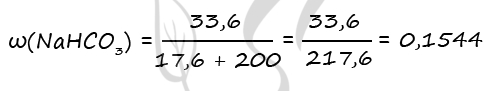
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7725.
Верный ответ: 50

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7718.

Верный ответ: 24
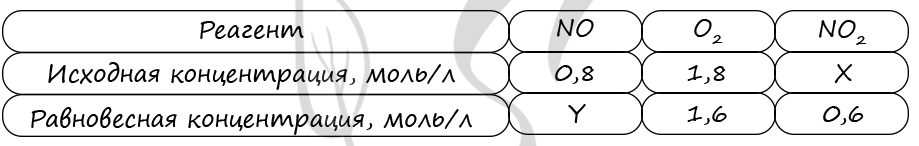
Таблица (по условию)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7697.
1) Общая формула вещества - CxHyOzNm
Вычислим массовую долю углерода
ω(C) = 100 - 13,33 - 10,48 - 30,48 = 45,71%
x : y : z : m = 45,71/12 : 10,48/1 : 30,48/16 : 13,33/14
Соотношение атомов С, H, O и N
x : y : z : m = 3,81 : 10,48 : 1,91 : 0,95 = 4 : 11 : 2 : 1
Молекулярная формула - C4H11O2N
2) Структурная формула
CH3COO[NH3CH2CH3]
3) Уравнение реакции
CH3COOAg + Br[NH3CH2CH3] = CH3COO[NH3CH2CH3] + AgBr
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7691.
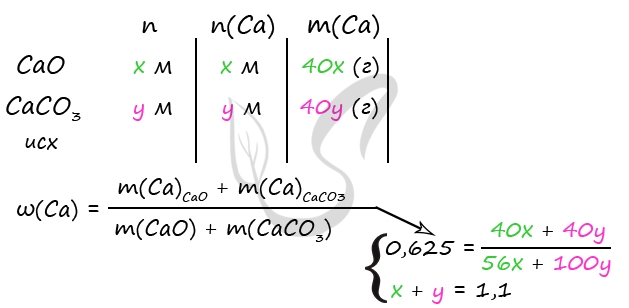
1) Уравнения реакций
CaO + 2HCl = CaCl2 + H2O (1)
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ (2)
CO2 + NaOH = NaHCO3 (3)
CO2 + 2NaOH = Na2CO3 + H2O (4)
2) Запишем формулу массы раствора после реакций 1 и 2
m (р-ра после реакции 1, 2) = m(CaO) + m(CaCO3) + m(HCl)р-ра - m(CO2)
3) Примем n(CaO) = x моль, n(CaCO3) = y моль
m(CaO) = 56x (г)
m(CaCO3) = 100y (г)
n(CaCO3) = n(CO2) = y моль (по уравнению 2)
m(CO2) = 44y (г)
Составим систему уравнений:
361,6 = 56x + 100y + 300 - 44y
x + y = 1,1


P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7690.