

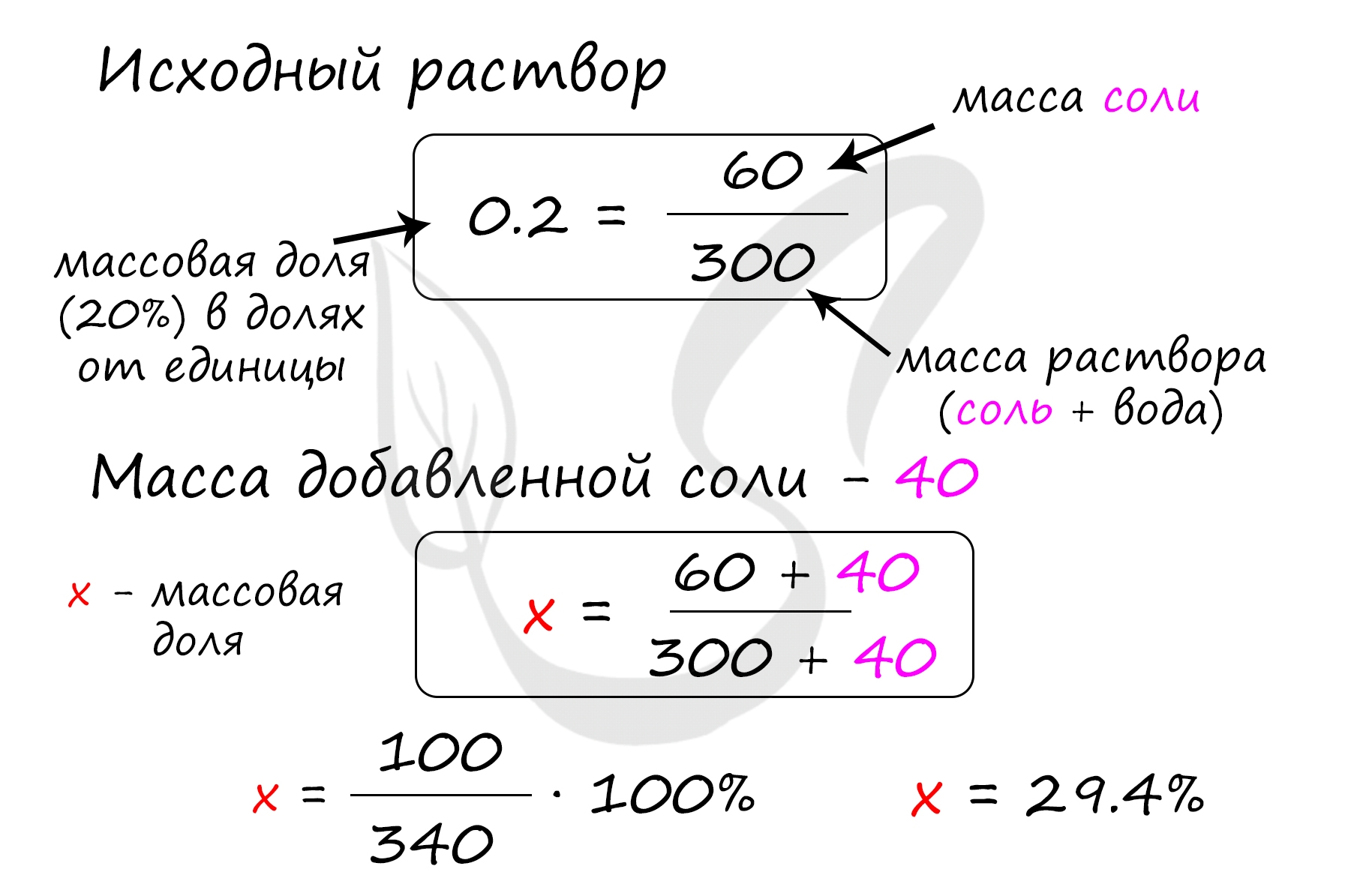
Верный ответ: 29,4
Найдем массу соли, которая присутствует в исходном растворе:
m(соли) = 300 · 0.2 = 60 грамм
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7683.
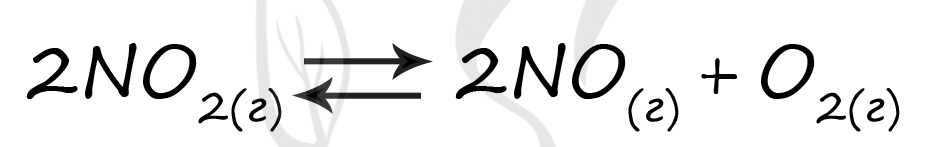
Верный ответ: 25
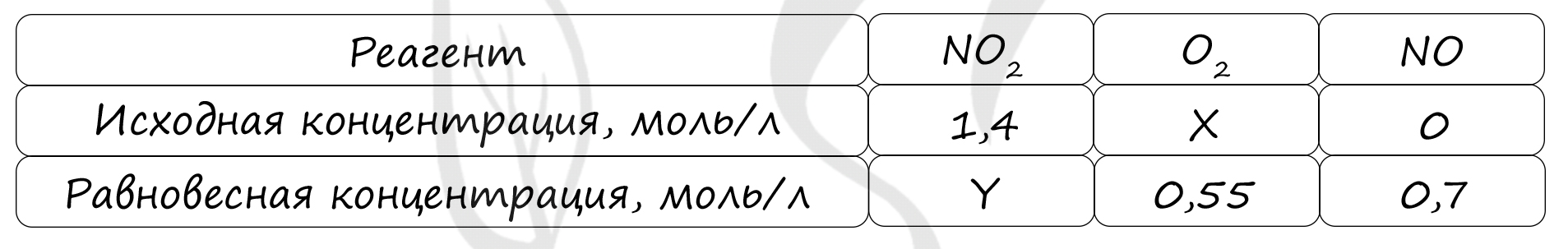
Таблица (по условию)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7662.
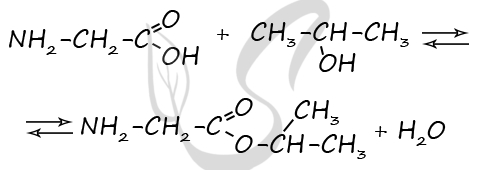
1) Общая формула - CxHyOzNm
Вычислим массовую долю углерода
ω(C) = 100 - 9,4 - 27,35 - 11,97 = 51,28%
x : y : z : m = (51,28 / 12) : (9,4 / 1) : (27,35 / 16) : (11,97 / 14)
Соотношение атомов: x : y : z : m = 5 : 11: 2 : 1
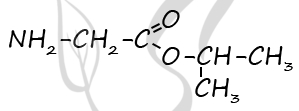
Молекулярная формула - C5H11O2N
2) Структурная функция
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7656.
1) Уравнения реакций
CaC2 + 2HCl = CaCl2 + C2H2↑ (1)
Al4C3 + 12HCl = 4AlCl3 + 3CH4↑ (2)
AlCl3 + 3NaHCO3 = Al(OH)3↓ + 3CO2↑ + 3NaCl (3)
CaCl2 + 2NaHCO3 = CaCO3 + CO2 + H2O + 2NaCl (4 - данная реакция не идет, так как ее обязательным условием является нагревание, о котором в тексте задачи не упоминается)
2) Вычислим массу карбида алюминия
m(NaHCO3) = 1260 ⋅ 0,08 = 100,8 г
n(NaHCO3) = 100,8 : 84 = 1,2 моль
n(AlCl3) = 1/3 ⋅ n(NaHCO3) = 1/3 ⋅ 1,2 = 0,4 моль (по уравнению 3)
n(Al4C3) = 1/4 ⋅ n(AlCl3) = 1/4 ⋅ 0,4 = 0,1 моль (по уравнению 2)
m(Al4C3) = 0,1 моль ⋅ 144 г/моль = 14,4 г
3) Вычислим количество вещества карбида кальция
Примем n(CaC2) = x моль
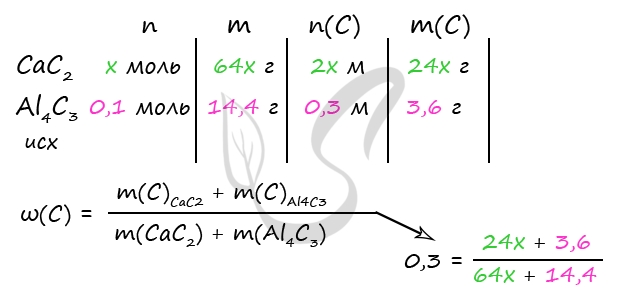
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7655.
Верный ответ: 30,5
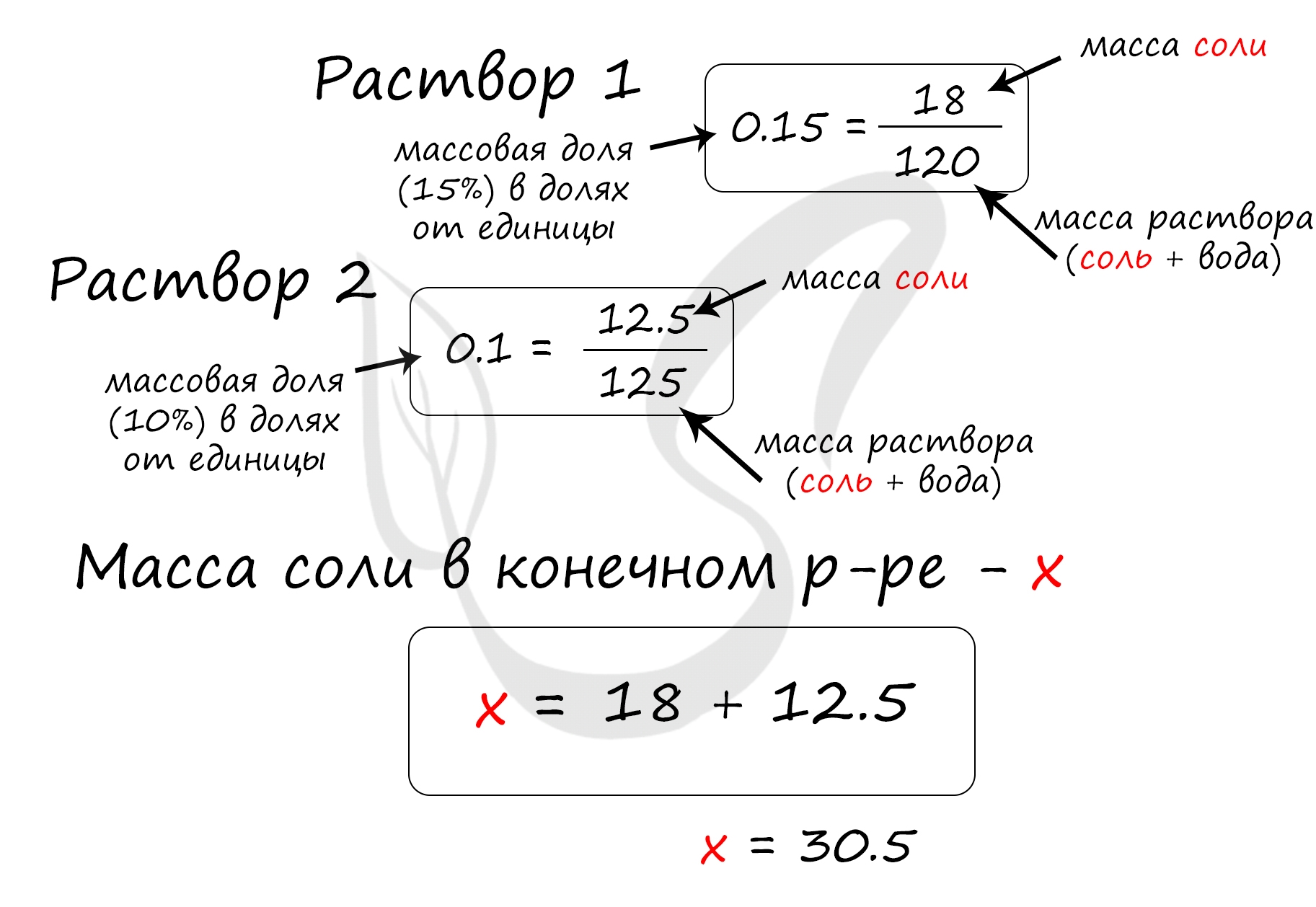
Найдем массу соли, которая присутствует в первом растворе:
m(соли)1 = 120 · 0.15 = 18 грамм
Найдем массу соли, которая присутствует во втором растворе:
m(соли)2 = 125 · 0.1 = 12.5 грамм
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7648.