Скорость химической реакции
Скорость химической реакции - основное понятие химической кинетики, выражающее отношения количества прореагировавшего вещества (в молях) к отрезку времени, за которое произошло взаимодействие.
Скорость реакции отражает изменение концентраций реагирующих веществ за единицу времени. Единицы измерения для гомогенной реакции: моль/л * сек. Физический смысл в том, что каждую секунду какое-то количество одного вещества превращается в дру
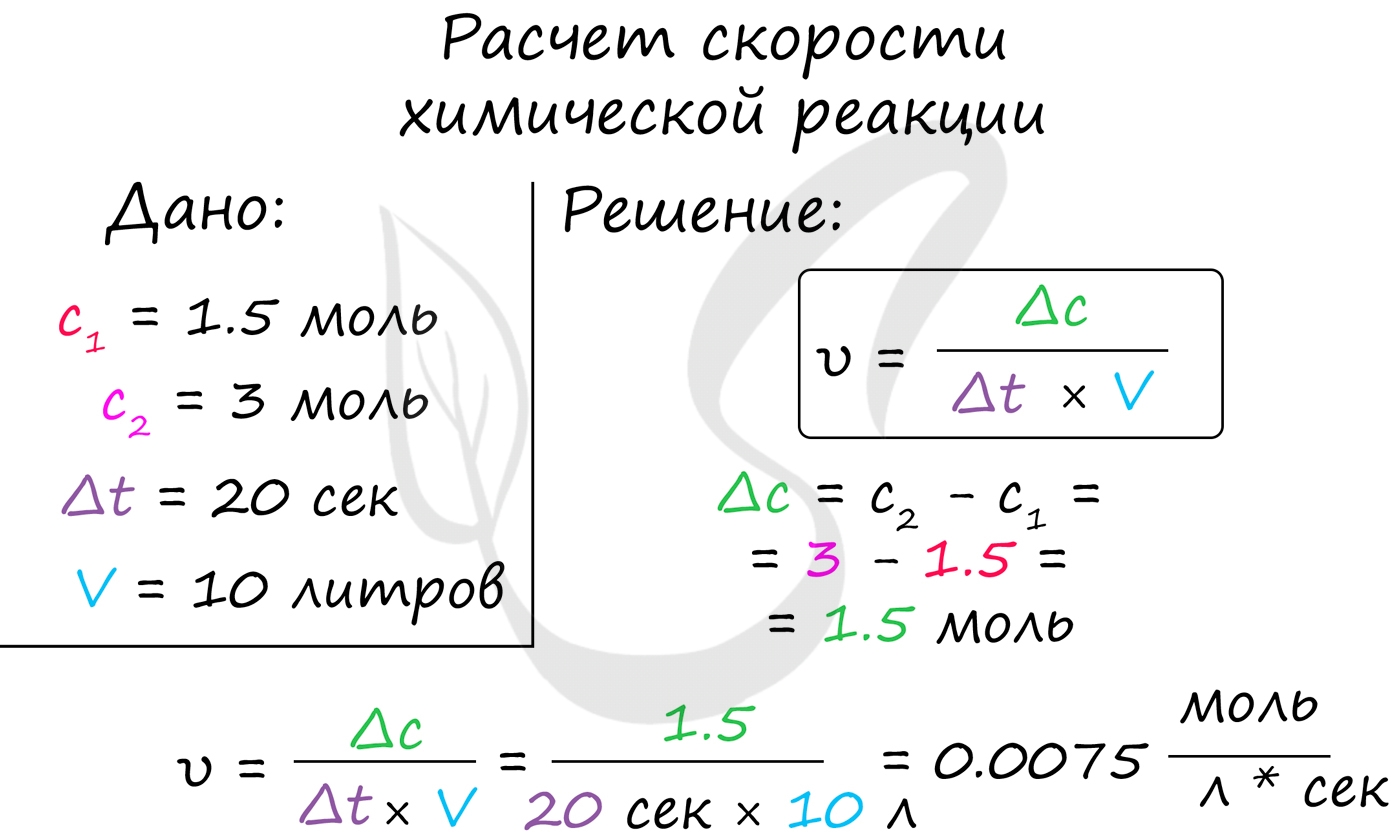
Мне встречались задачи, где была дана молярная концентрация вещества до реакции и после, время и объем. Требовалось посчитать скорость реакции. Давайте решим подобное несложное задание для примера:
Молярная концентрация вещества до реакции составляла 1.5 моль/л по итогу реакции - 3 моль/л. Объем смеси 10 литров, реакция заняла 20 секунд. Рассчитайте скорость реакции.
Влияние природы реагирующих веществ
При изучении агрегатных состояний веществ возникает вопрос: где же быстрее всего идут реакции: между газами, растворами или твердыми веществами?
Запомните, что самая высокая скорость реакции между растворами, в жидкостях. В газах она несколько ниже.
Если реакция гетерогенная: жидкость + твердое вещество, газ + твердое вещество, жидкость + газ, то большую роль играет площадь соприкосновения реагирующих веществ.
Очевидно, что большой кусок железа, положенный в соляную кислоту, будет гораздо дольше реагировать с ней, нежели чем измельченное железо - железная стружка.
Химическая активность также играет важную роль. Например, отвечая на вопрос "какой из металлов Fe или Ca быстрее прореагирует с серой?" мы отдадим предпочтение кальцию, так как в ряду активности металлов он стоит левее железа, а значит кальций активнее железа.
Иного подхода требуют реакции металлов с водой, где нужно учитывать радиус атома. Например, отвечая на вопрос "какой из металлов Li или K быстрее прореагирует с водой?" мы отдадим предпочтение калию, так как калий имеет больший радиус атома. Калий будет быстрее взаимодействовать с водой, чем литий.
Иногда для верного ответа на вопрос о скорости реакции требуется знание активности кислот. Мы подробнее обсудим эту тему в гидролизе, однако сейчас я замечу: чем сильнее (активнее) кислота, тем быстрее идет реакция.
Например, реакцию магния с серной кислотой протекает гораздо быстрее реакции магния с уксусной кислотой. Причиной этому служит то, что серная кислота относится к сильным (активным) кислотам, а активность уксусной кислоты меньше, она является слабой кислотой.
Как я уже упомянул, слабые и сильные кислоты и основания изучаются в теме гидролиз.
Влияние изменения концентрации
Влияние концентрации "прямо пропорционально" скорости реакции: при увлечении концентрации реагирующего вещества скорость реакции повышается, при уменьшении - понижается.
Замечу деталь, которая может оказаться важной, если в реакции участвуют газы: при увеличении давления концентрация вещества на единицу объема возрастает (представьте, как газ сжимается). Поэтому увеличение давление, если среди исходных веществ есть газ, увеличивает скорость реакции.
Закон действующих масс устанавливает соотношение между концентрациями реагирующих веществ и их продуктами. Скорость простой реакции aA + bB → cC определяют по уравнению:
υ = k × СaA × СbB
Физический смысл константы скорости - k - в том, что она численно равна скорости реакции при том условии, что концентрации реагирующих веществ равны 1. Обратите внимание, что стехиометрические коэффициенты уравнения переносятся в степени - a и b.
Записанное выше следствие закона действующих масс нужно не только "зазубрить", но и понять. Поэтому мы решим пару задач, где потребуется написать подобную формулу.
Окисление диоксида серы протекает по уравнению: 2SO2(г) + O2 = 2SO3(г). Как изменится скорость этой реакции, если объемы системы уменьшить в три раза?
По итогу решения становится ясно, что скорость реакции в таком случае возрастет в 27 раз.
Решим еще одну задачу. Дана реакция синтеза аммиака: N2 + ЗН2 = 2NH3. Как изменится скорость прямой реакции образования аммиака, если уменьшить концентрацию водорода в два раза?
В результате решения мы видим, что при уменьшении концентрации водорода в два раза скорость реакции замедлится в 8 раз.
Влияние изменения температуры на скорость реакции
Постулат, который рекомендую временно взять на вооружение: "Увеличение температуры увеличивает скорость абсолютно любой химической реакции: как экзотермической, так и эндотермической. Исключений нет!"
Очень часто в заданиях следующей темы - химическом равновесии, вас будут пытаться запутать и ввести в заблуждение, но вы не поддавайтесь и помните про постулат!
Итак, влияние температуры на скорость реакции "прямо пропорционально": чем выше температура, тем выше скорость реакции - чем ниже температура, тем меньше и скорость реакции. Однако, как и в случае с концентрацией, это больше чем простая "пропорция".
Правило Вант-Гоффа, голландского химика, позволяет точно оценить влияние температуры на скорость химической реакции. Оно звучит так: "При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза"
В формуле, написанной выше, используются следующие обозначение:
- υ1 - скорость реакции при температуре t1
- υ2 - скорость реакции при температуре t2
- γ - температурный коэффициент, который может быть равен 2-4
Если по итогам решения задач у вас получится температурный коэффициент меньше 2 или больше 4, то, скорее всего, где-то вы допустили ошибку. Используйте этот факт для самопроверки.
Для тренировки решим пару задач, в которых потребуется использование правило Вант-Гоффа.
Как изменится скорость гомогенной реакции при повышении температуры от 27°C до 57°C при температурном коэффициенте, равном трем?
Иногда в задачах требуется рассчитать температурный коэффициент, как, например, здесь: "Рассчитайте, чему равен температурный коэффициент скорости, если известно, что при понижении температуры от 250°C до 220°C скорость реакции уменьшилась в 8 раз".
Катализаторы и ингибиторы
Катализатор (греч. katalysis — разрушение) - вещество, ускоряющее химическую реакцию, но не участвующее в ней. Катализатор не расходуется в химической реакции.
Многие химические реакции в нашем организме протекают с участием катализаторов - белковых молекул, ферментов. Без катализаторов подобные реакции шли бы сотни лет, а с катализаторами идут одну долю секунды.
Катализом называют явление ускорения химической реакции под действием катализатора, а химические реакции, идущие с участием катализатора - каталитическими.
Ингибитор (лат. inhibere - задерживать) - вещество, замедляющее или предотвращающее протекание какой-либо химической реакции.
Ингибиторы применяют для замедления коррозии металла, окисления топлива, старения полимеров. Многие лекарственные вещества являются ингибиторами.
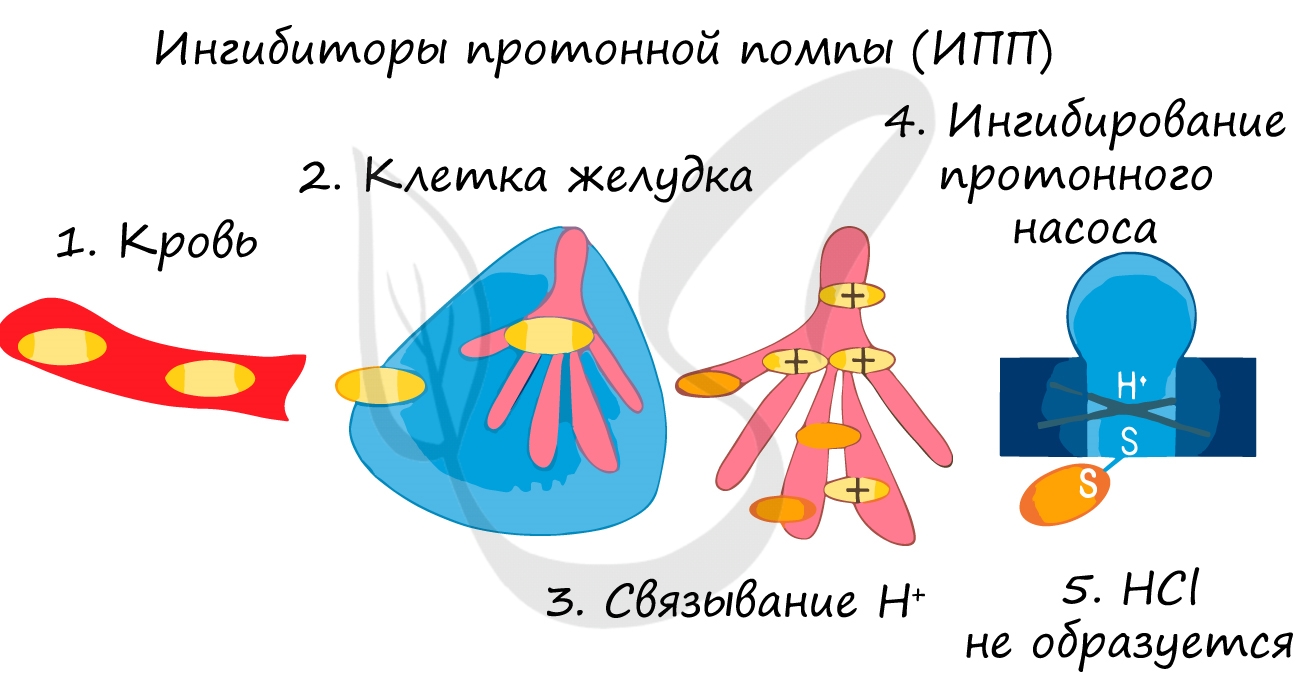
Так при лечении гастрита - воспаления желудка (греч. gaster - желудок) или язв часто назначаются ингибиторы протонной помпы - химические вещества, которые блокирует выработку HCl слизистой желудке. В результате этого соляная кислота прекращает воздействие на поврежденную стенку желудка, воспаление стихает.
© Беллевич Юрий Сергеевич 2018-2024
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.