Галогены
Галогены (греч. hals - соль + genes - рождающий) - химические элементы VIIa группы: F, Cl, Br, I, At. Реагируют с большинством других элементов и органических соединений.
Галогены широко распространены в природе. Их химическая активность падает от фтора к астату.
Общая характеристика элементов VIIa группы
От F к At (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Все галогены относятся к неметаллам, являются сильными окислителями.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np5:
- F - 2s22p5
- Cl - 3s23p5
- Br - 4s24p5
- I - 5s25p5
- At - 6s26p5
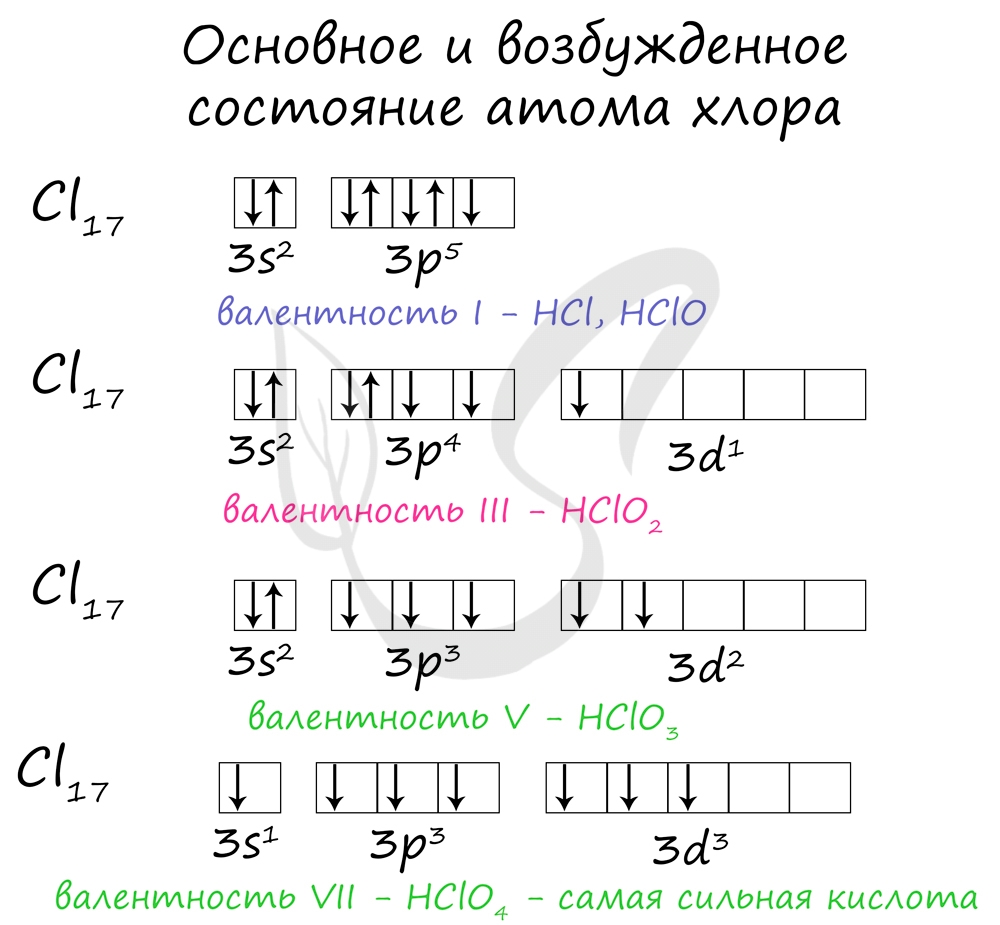
Для галогенов характерны нечетные степени окисления: -1, +1, +3, +5, +7. Это связано с электронной конфигурацией атомов в возбужденном состоянии.
Природные соединения
- NaCl - галит (каменная соль)
- CaF2 - флюорит, плавиковый шпат
- NaCl*KCl - сильвинит
- 3Ca3(PO4)2*CaF2 - фторапатит
- MgCl2*6H2O - бишофит
- KCl*MgCl2*6H2O - карналлит
Простые вещества - F2, Cl2, Br2, I2
Галогены в чистом виде можно получить путем электролиза водных растворов и расплавов их солей. Например, хлор в промышленности получают электролизом водного раствора хлорида натрия.
NaCl + H2O → (электролиз) NaOH + H2↑ + Cl2↑
Электролизом расплава гидрофторида калия KHF2 в безводной плавиковой кислоте - HF - был впервые получен фтор.
HF → F2 + H2
Более активные галогены способны вытеснять менее активные. Активность галогенов убывает: F → Cl → Br → I.
Cl2 + KBr → Br2 + KCl
Cl2 + KI → I2 + KCl
В лабораторных условиях галогены могут быть получены следующими реакциями.
HCl + MnO2 → MnCl2 + Cl2 + H2O
HCl + KMnO4 → MnCl2 + Cl2 + KCl + H2O
Химические свойства
- Реакции с металлами
- Реакции с неметаллами
- Реакции с водой
- Реакции с щелочами
- Окислительные способности
Для галогенов характерна высокая реакционная способность. Фтор реагирует со всеми металлами без исключения, некоторые из них в атмосфере фтора самовоспламеняются.
Al + F2 → AlF3
Cu + Cl2 → CuCl2
Na + Br2 → NaBr
Хлор, как и фтор, химически весьма активен. Не реагирует только с кислородом, азотом и благородными газами.
Cl2 + Si → SiCl4
Cl2 + H2 → HCl (на свету)
F2 + H2 → HF (в темноте со взрывом)
Галогены вступают в реакцию друг с другом. Чтобы определить степени окисления в получающихся соединениях, вспомните электроотрицательность ;)
Br2 + F2 → BrF (фтор более электроотрицателен, чем бром - F-)
Br2 + I2 → IBr3 (бром более электроотрицателен, чем йод - Br-)
Реакция фтора с водой протекает очень энергично, носит взрывной характер.
H2O + F2 → HF + O2
Хлор реагирует с водой обратимо, образуя хлорную воду - смесь хлорноватистой и соляной кислоты. Бром вступает в те же реакции, что и хлор.
Cl2 + H2O → HCl + HClO
H2O + Br2 → HBr + HBrO
Замечу, что активность йода существенно ниже, чем у остальных галогенов. С неметаллами йод почти не реагирует, а с металлами - только при нагревании.
Cl2 + NaOH → NaCl + NaClO + H2O
Cl2 + NaOH → (t) NaCl + NaClO3 + H2O
Галогены способны вытеснять друг друга из солей. Более активные вытесняют менее активные.
KCl + F2 → KF + Cl2
KBr + Cl2 → KCl + Br2
KBr + I2 ⇸ (реакция не идет, так как йод менее активен, чем бром)
Галогеноводороды
Соединения, образованные из галогенов и водорода. К галогеноводородам относятся следующие вещества:
- HF - фтороводород (газ), фтороводородная (плавиковая) кислота (жидкость)
- HCl - хлороводород (газ), соляная кислота (жидкость)
- HBr - бромоводород, бромоводородная кислота
- HI - йодоводород, йодоводородная кислота
- HAt - астатоводород, астатоводородная кислота
При н.у. HCl, HBr, HI - газы, хорошо растворимые в воде.
Получение
В промышленности применяют получение прямым методом: реакцией водорода с галогенами.
H2 + Cl2 → HCl
В лабораторных условиях галогеноводороды можно получить в реакциях обмена между галогенсодержащими солями и сильными кислотами.
NaCl + H2SO4 → NaHSO4 + HCl↑
CaF2 + H2SO4 → CaSO4 + HF
PBr3 + H2O → HBr↑ + H3PO3
H2S + I2 → S + HI
Химические свойства
- Кислотные свойства
- С солями
- Восстановительные свойства
- Реакция с оксидом кремния
HF - является слабой кислотой, HCl, HBr, HI - сильные кислоты. Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из кислоты.
Mg + HBr → MgBr2 + H2↑
Zn + HCl → ZnCl2 + H2↑
Галогеноводороды реагируют с основными, амфотерными оксидами и основаниями с образованием соответствующих солей.
Na2O + HCl → NaCl + H2O
ZnO + HI → ZnI2 + H2O
KOH + HCl → KCl + H2O (реакция нейтрализации)
Cr(OH)3 + HCl → CrCl3 + H2O
Реакции протекают в тех случаях, если в результате выпадает осадок, выделяется газ или образуется слабый электролит (вода).
AgNO3 + HCl → AgCl + HNO3
Li2CO3 + HBr → LiBr + H2CO3
В некоторых реакциях проявляют себя как сильные восстановители, особенно HI.
HI + MnO2 → I2 + MnI2 + H2O
HI + H2SO4 → I2 + H2S + H2O
HI + O2 → H2O + I2
HI + Br2 → HBr + I2
HBr + H2SO4 → Br2 + SO2 + H2O
В целом взаимодействие галогеноводородов с оксидами неметаллов нехарактерно. В этой связи важно выделить реакцию SiO2 с плавиковой кислотой.
SiO2 + HF → SiF4 + H2O
© Беллевич Юрий Сергеевич 2018-2024
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.