


Для выполнения заданий 1-3 используйте следующий ряд химических элементов:
Ответом в заданиях 1-3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Верный ответ: 14
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7132.
Верный ответ: 543
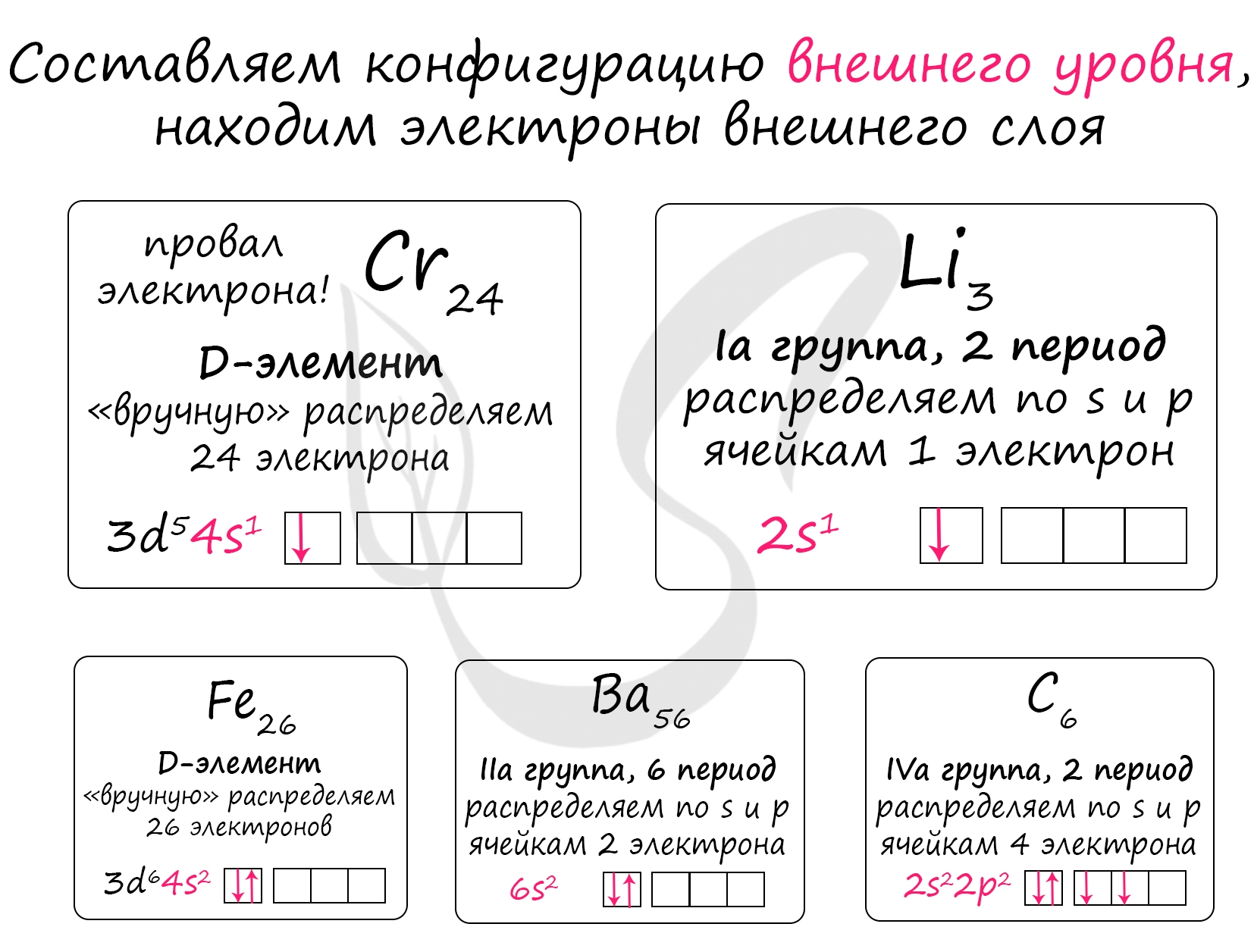
Переходные элементы - это элементы, которые относятся к побочным (В) подгруппам. В данном случае просят найти непереходные - то есть элементы, которые относятся к главным (А) подгруппам. Это барий (Ba), литий (Li) и углерод (C).
Далее просят расположить данные элементы в порядке возрастания атомного радиуса. Необходимо помнить, что атомный радиус элементов увеличивается в периодической системе Менделеева - в периоде справа налево (←) и в группе сверху вниз (↓).
Увеличение радиуса атома в периоде (←) связано с уменьшением числа электронов на внешнем уровне за счёт чего электроны чувствуют себя свободнее и радиус атома больше. Увеличение радиуса атома в группе (↓) связано с увеличением числа электронных орбиталей (уровней).
Очевидно, что барий (3) имеет самый большой радиус атома, так как располагается в 6 периоде и поэтому он в нашем списке (в порядке возрастания) будет на последнем месте.
Сравнивая между собой литий и углерод (оба во 2 периоде), мы приходим к выводу, что радиус атома лития больше, так как на его внешнем уровне один электрон, а у углерода их четыре, поэтому радиус атома возрастает: C (5) → Li (4)
Итог: радиус атома возрастает C (5) → Li (4) → Ba (3)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7133.
Верный ответ: 12
Образуют соединения в степени окисления +6:
1) Хром может проявлять степени окисления (СО): +2 (CrO), +3 (Cr2O3), +6 (Na2CrO4)
2) Железо - +2 (FeO), +3 (Fe2O3), +6 (K2FeO4)
Остальные пункты:
3) Ba - образует оксиды в степени окисления +2 (BaO)
4) Li - постоянная степень окисления +1
5) C - все степени окисления от -4 (CH4) до +4 (CO2)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7134.
Верный ответ: 35
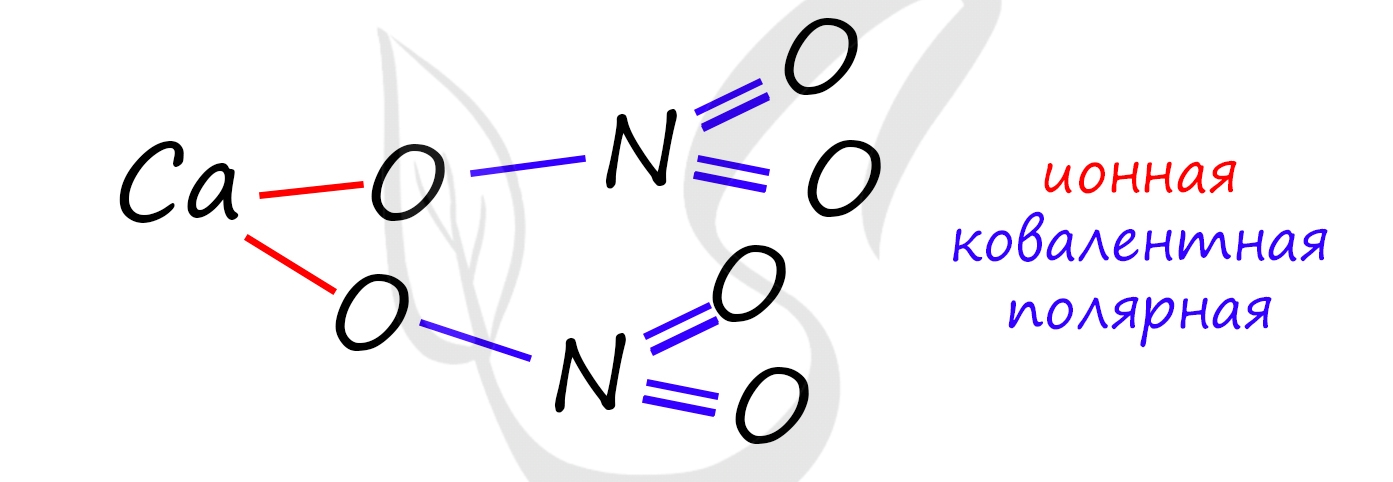
Ковалентная полярная связь осуществляется между двумя разными атомами элементов-неметаллов. Типичный пример - молекула воды (H2O). Ковалентная полярная химическая связь присутствует в
3) Ca(NO3)2 - нитрат кальция, сложное соединение, которое имеет несколько типов атомов как элементов металлов, так и неметаллов. Тут кроется хитрость, заключающаяся в том, что здесь 2 вида связей. Между металлом кальцием (Ca) и кислотным остатком азотной кислоты нитратом (NO3) связь ионная, а между кислородом и азотом в кислотном остатке - ковалентная полярная. Обратите особое внимание на данный момент!
5) C2H6 - этан, органическое вещество, углеводород, но не стоит пугаться этого, связь между углеродом и водородом (C-H) - ковалентная полярная
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6960.

Верный ответ: 512
Под цифрами:
1 - сульфат лития калия - двойная соль (два катиона)
2 - гексацианоферрат(III) калия - комплексная соль
3 - дигидроксокарбонат железа(II), основная соль (наличие гидроксид-ионов)
4 - нитрид натрия, бинарное неорганическое соединение металла натрия и азота
5 - бромид-хлорид кальция - смешанная соль (два аниона)
6 - гидрофосфат калия, кислая соль (наличие водорода в кислотном остатке) ортофосфорной кислоты
7 - хлорат калия, средняя соль хлорноватой кислоты (HClO3 - сильная одноосновная)
8 - цианид серебра(I), средняя соль синильной (цианистоводородной) кислоты
9 - цинкат натрия, смесь оксидов металлов натрия и цинка
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7171.
1) сульфат бария
2) серная кислота
3) карбонат кальция
4) гидроксид натрия
5) оксид меди(II)
Верный ответ: 52
Оксид меди (II) не растворяется в воде, так как теоретический продукт такой реакции - гидроксид меди (II) является нерастворимым соединением: нельзя из одного нерастворимого вещества в растворе получить другое нерастворимое вещество, если только мы не в Хогвартсе :)
Оксид меди (II) обладает основными свойствами и отлично прореагирует с серной кислотой с образованием сульфата меди (II) и воды:
CuO + H2SO4 → CuSO4 + H2O
Реакции между нерастворимым оксидом меди (II) и сульфатом бария (соль), карбонатом кальция (соль), гидроксидом натрия (основание) невозможны.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7558.
Верный ответ: 2553
В этом задании скрыты 60 реакций! Правильный подход к его выполнению может значительно повысить ваш уровень знаний неорганической химии
Итак, ключевой момент: нужно попробовать составить реакцию каждого из веществ (А, Б, В, Г) со всеми предложенными реагентами! Вы должны узнать, возможна ли каждая из этих реакций, или понять причину, по которой она невозможна (например, в реакции не может быть два осадка: и справа, и слева). Следуйте такому подходу, и вы удивитесь, как быстро повысится ваш "неорганический уровень" ;)
Реакции для Ba(OH)2 протекают так:
Ba(OH)2 + CrO3 → BaCrO4
Ba(OH)2 + P2O5 → Ba3(PO4)2
Ba(OH)2 + Li2SO4 → BaSO4↓ + LiOH
Реакции для FeS протекают так:
FeS + HCl → FeCl2 + H2S
FeS + O2 → Fe2O3 + H2S
FeS + HNO3 → Fe(NO3)3 + H2SO4 + NO + H2O
Реакции для Ba протекают так:
Ba + HCl → BaCl2 + H2↑
Ba + O2 → BaO
Ba + HNO3 → Ba(NO3)2 + N2O↑ + H2O
Реакции для SO2 протекают так:
SO2 + O2 → (кат.) SO3
SO2 + H2O ⇆ H2SO3
SO2 + NaOH → NaHSO3
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7909.
Верный ответ: 1542
А) Это банальная реакция обмена между гидроксидом хрома (III) и серной кислотой, важно сохранить исходную степень окисления хрома (+3), именно поэтому в продуктах мы выбираем сульфат хрома (III); вода образуется при соединении гидроксид-ионов основания и протонов кислоты
Cr(OH)3 + H2SO4 → Cr2(SO4)3 + H2O
Б) При реакции амфотерного гидроксида с основанием в растворе образуется комплексная соль
Cr(OH)3 + NaOH → Na3[Cr(OH)6]
В) При реакции амфотерного гидроксида с основанием при прокаливании (нагревании) образуются смешанные оксиды (хромит натрия это по сути смесь оксидов натрия и хрома), испаряется вода
Cr(OH)3 + NaOH → (t°) NaCrO2 + H2O
Г) При нагревании нерастворимые гидроксиды легко отдают воду, исходную степень окисления хрома (+3) сохраняем
Cr(OH)3 → (t°) Cr2O3 + H2O
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7560.

1) Br2(р-р)
2) NaNO3(р-р)
3) SO2
4) NaOH
5) H2S
Верный ответ: 14
Вещество X - (1) - Br2(р-р)
Для окисления сернистой кислоты до серной нужен сильный окислитель, подойдёт бром (1)
H2SO3 + Br2 = H2SO4 + HBr
Cероводород (5) напротив является хорошим восстановителем, поэтому его выбирать не нужно
Вещество Y - (4) - NaOH
В реакциях оснований с многоосновными кислотами (в избытке) образуются кислые соли
NaOH + H2SO4 = NaHSO4 + H2O
Если бы в избытке было основание, то мы могли бы получить среднюю соль
2NaOH + H2SO4 = Na2SO4 + 2H2O
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7106.
Верный ответ: 3142
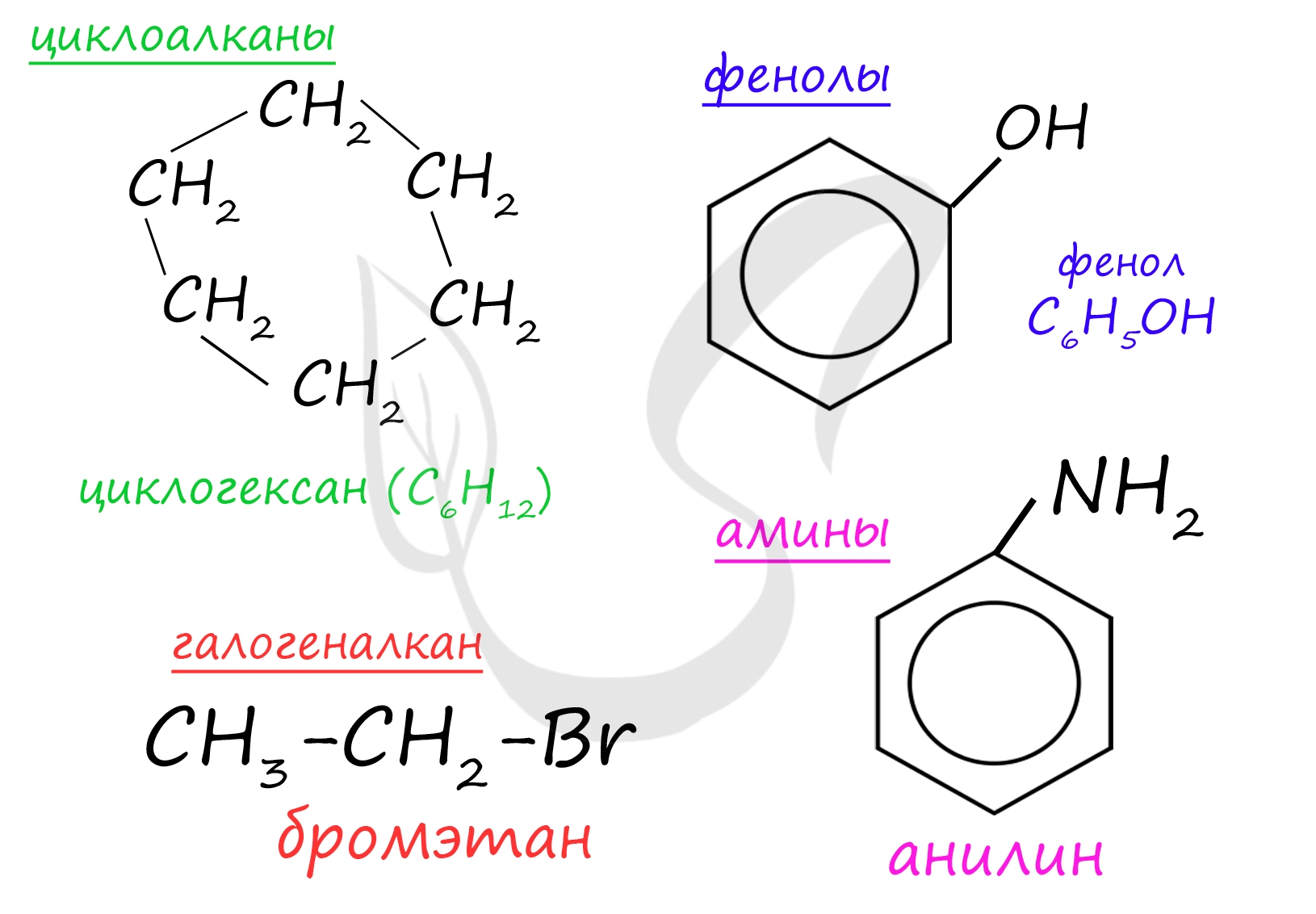
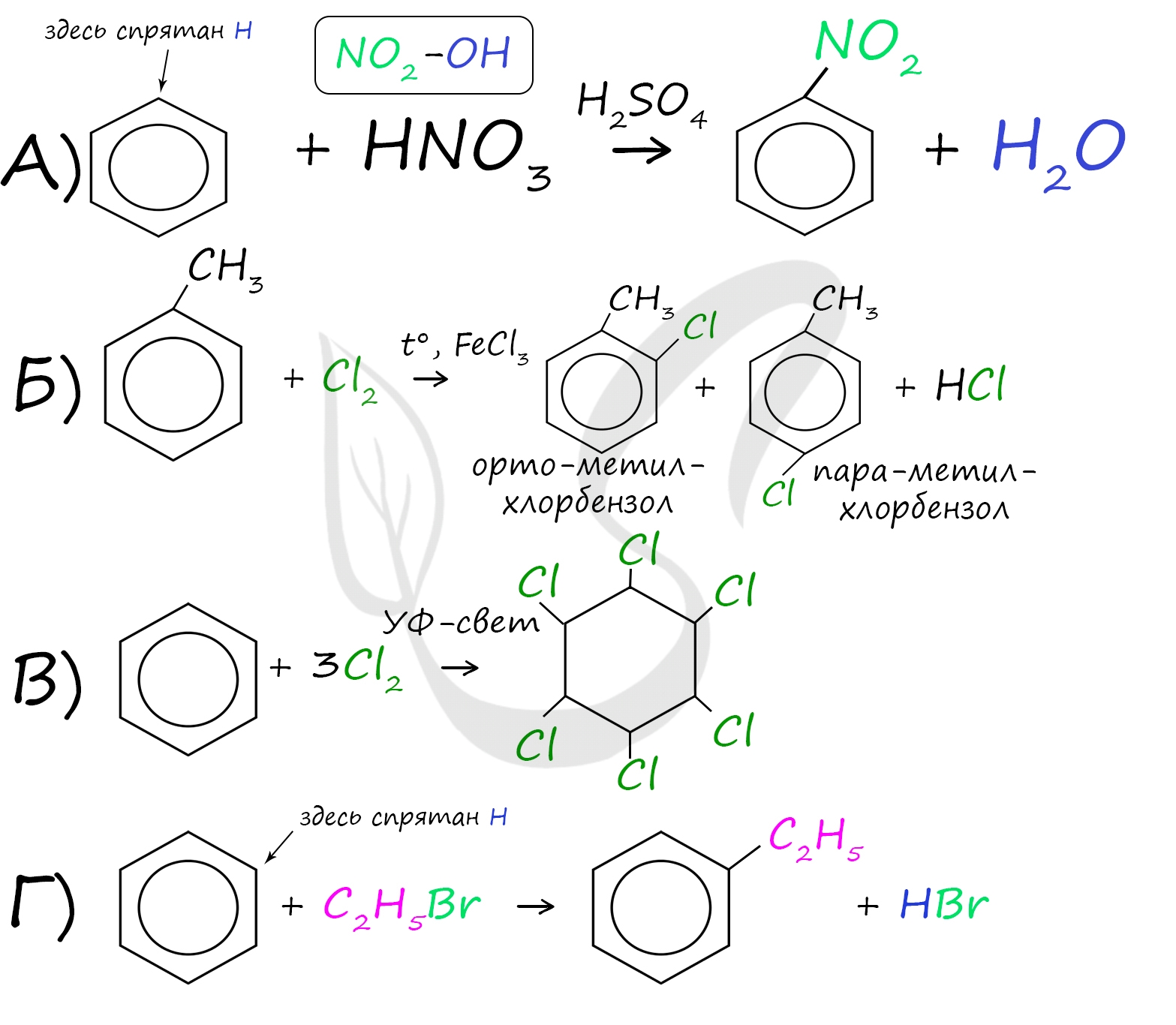
А) Циклоалканы (циклогексан) - общая формула CnH2n - циклические насыщенные (предельные) углеводороды, нет двойных/тройных связей
Б) Фенолы (гидроксибензол) - общая формула CnH2n-7OH - наличие гидроксильной группы (OH), которая связана с бензольным кольцом
В) Галогеналканы - алканы, которые содержат в своём составе связь «углерод - галоген»
Г) Ароматические амины (анилин) - производные ароматических углеводородов - общая формула CnH2n–6, в которых один или несколько атомов водорода бензольного кольца замещены на аминогруппы (NH2)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7842.
Верный ответ: 14
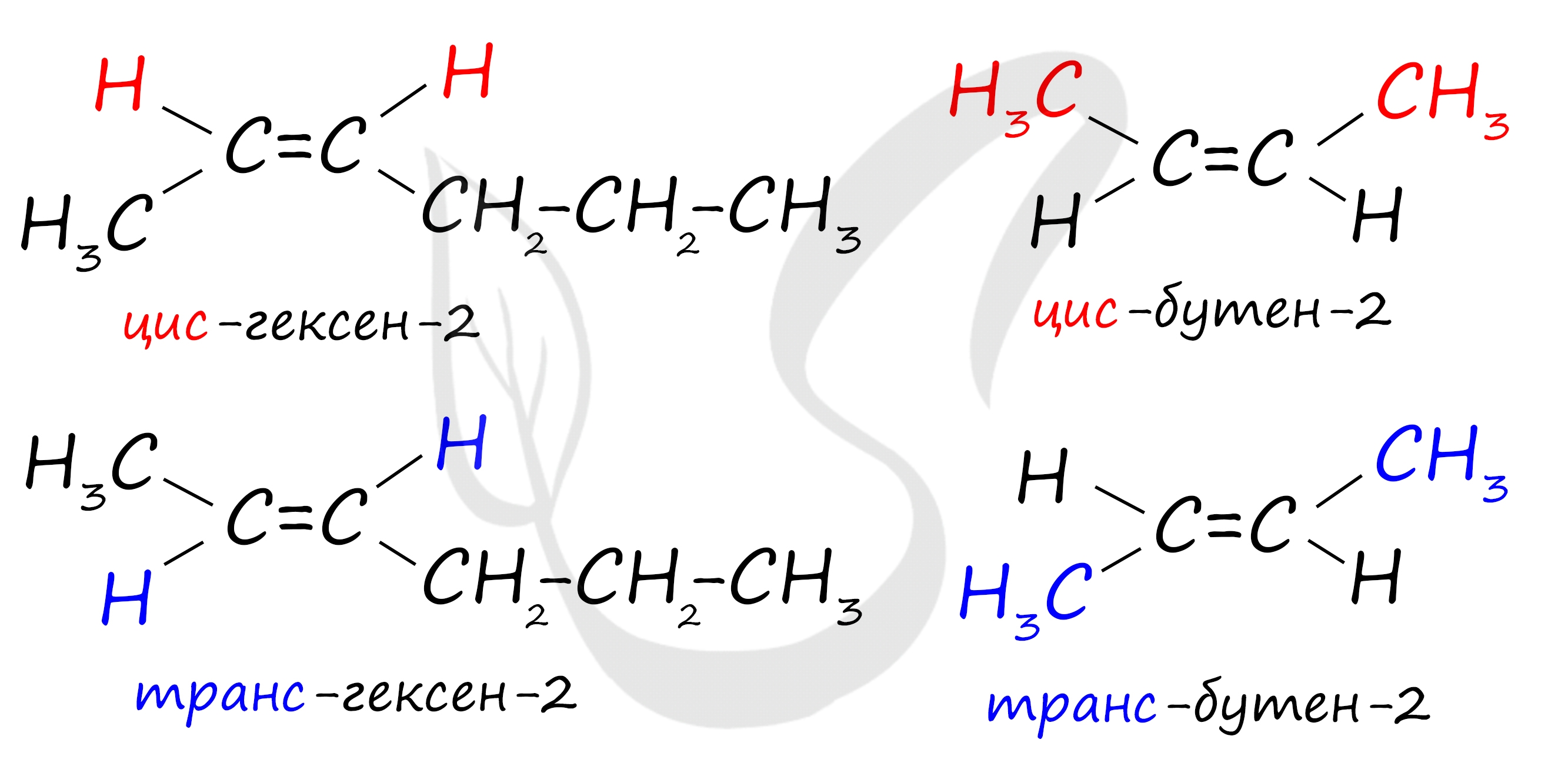
В виде цис- и транс-изомеров могут существовать алкены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6863.
Верный ответ: 125
В реакциях замещения следует выбирать (для отщепления водорода) вторичный атом углерода расположенный в самом центре молекулы пентана, поскольку на него подаётся много электронной плотности и он легче отдаёт водород, чем любой другой атом углерода в молекуле пентана

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7459.
Верный ответ: 13
1 - все органические вещества сгорают с образованием углекислого газа и воды (и азота, если это азотсодержащее соединение, как в данном случае)
3 - амины обладают основными свойствами и вступают в реакции с кислотами
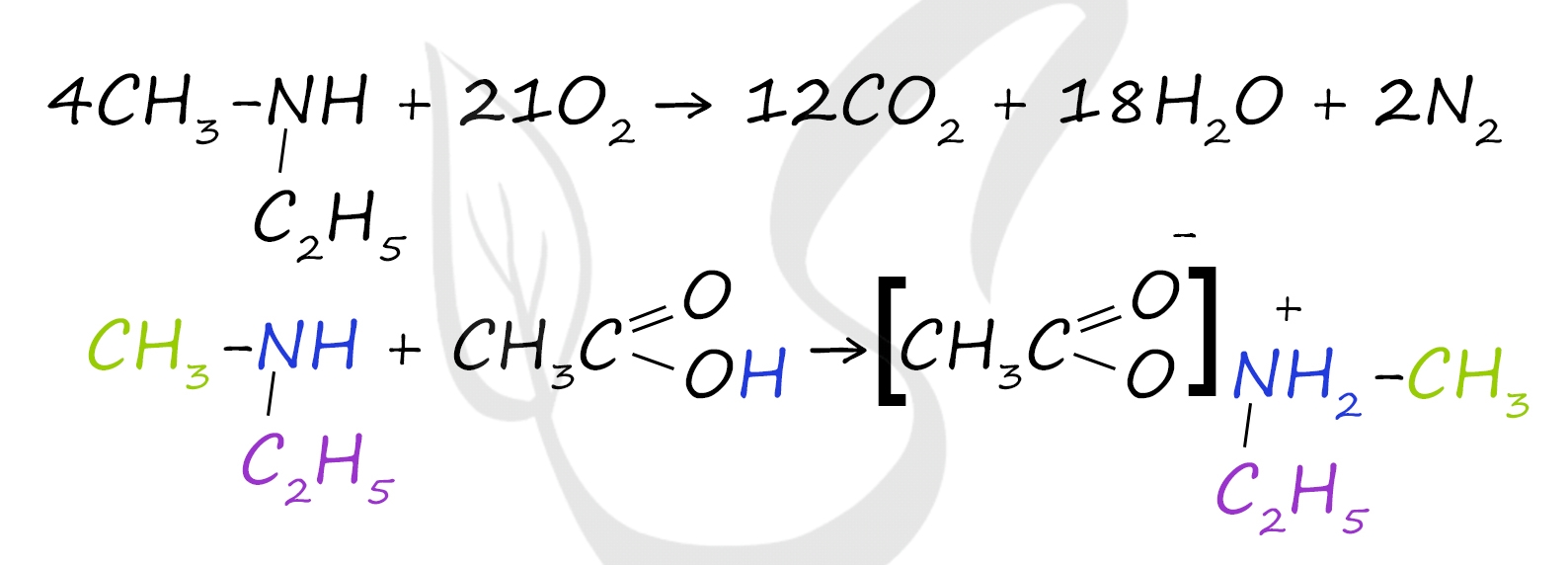
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6761.
Верный ответ: 1453
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7392.
Верный ответ: 6235

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7883.

1) NaOH (спирт.)
2) C6H5OH
3) NaOH (водн.)
4) H2
5) Na
Верный ответ: 35
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7849.
Верный ответ: 25
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7640.
Верный ответ: 14
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7921.
Верный ответ: 5234
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7362.
Верный ответ: 3521
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7748.
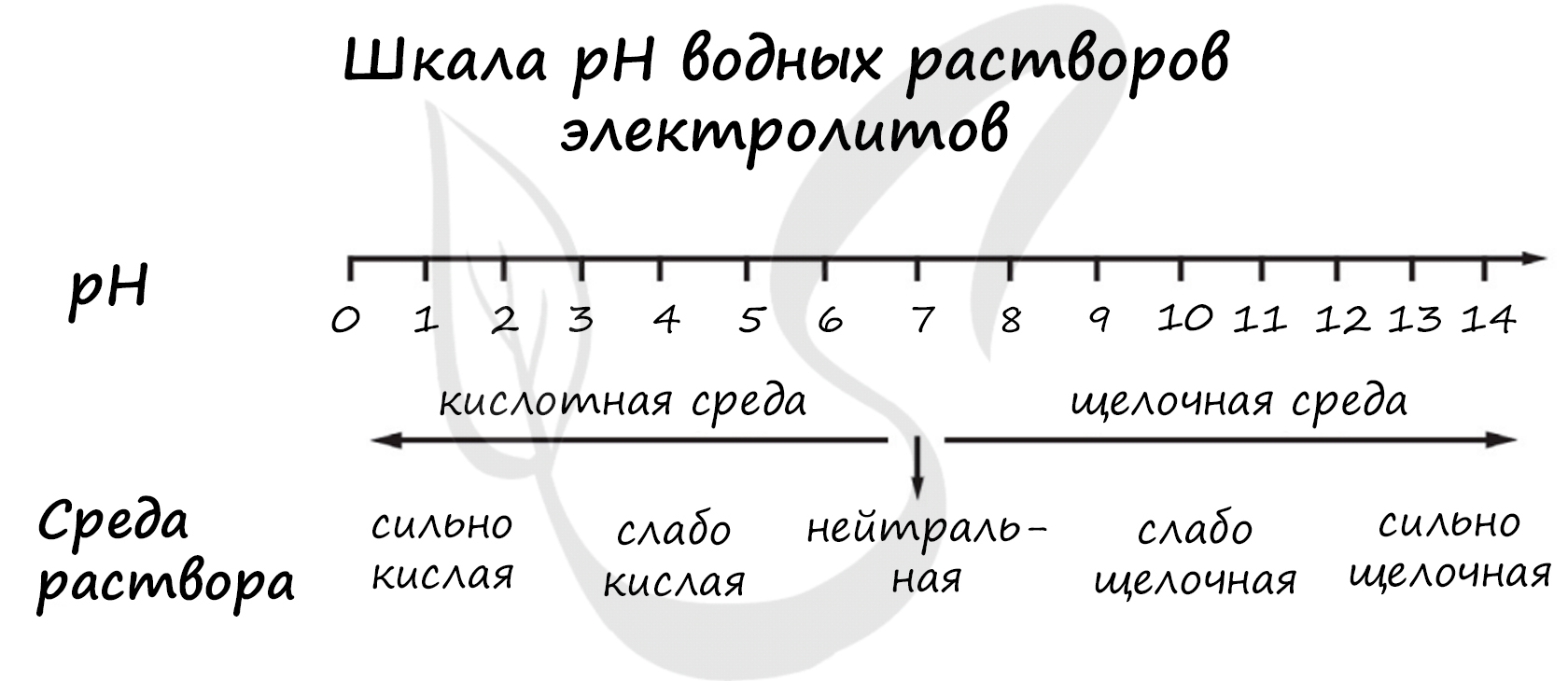
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») - водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.
1) гидроксид калия
2) хлорид брома
3) этиламин
4) хлорид хрома (III)
Верный ответ: 2431
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7889.
Верный ответ: 3311
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7610.

Верный ответ: 31
Таблица (по условию)

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7627.
Верный ответ: 3145
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7681.
Верный ответ: 243
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7157.
Ответом к заданиям 26-28 является число. Запишите это число в поле ответа в тексте работы, соблюдая при этом указанную степень точности. Единицы измерения физических величин указывать не нужно.
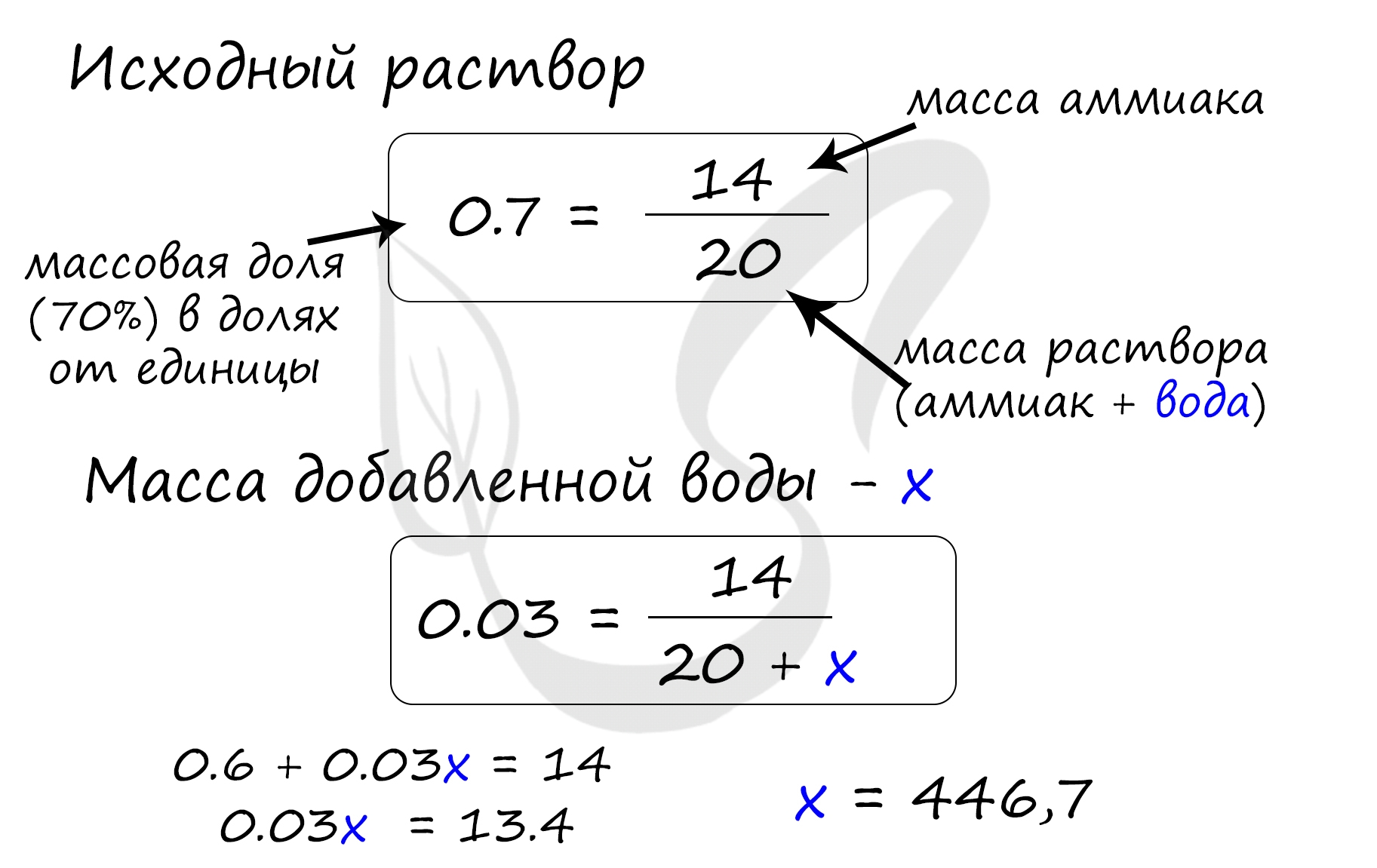
Верный ответ: 446,7
Найдем массу уксусной кислоты, которая присутствует в исходном растворе:
m(кислоты) = 20 · 0.7 = 14 грамм
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7753.
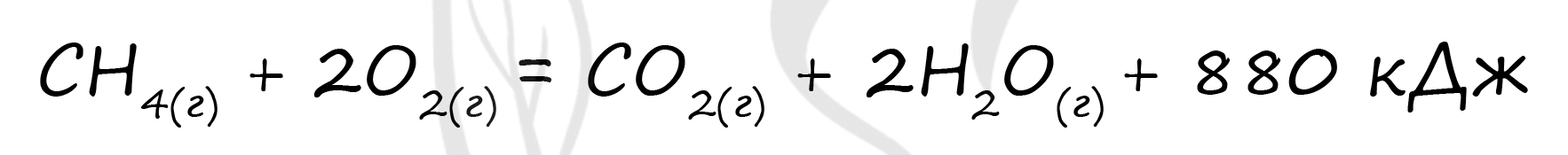
Верный ответ: 0,4

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7019.
Верный ответ: 80,0
BaCl2 + ZnSO4 = BaSO4↓ + ZnCl2
1) n(BaSO4) = m / Mr = 116,5 г / 233 г/моль = 0,5 моль
2) n(BaCl2) = n(BaSO4) = 0,5 моль
3) m(BaCl2) = n · Mr = 0,5 моль · 208 г/моль = 104 г
4) w(BaCl2) = 104 г / 130 г · 100% = 80%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6845.
Часть 2 Вы проверяете сами. Все пояснения и подсказки к частям 1 и 2 обязательно будут даны по окончании теста.
Для выполнения заданий 29,30 используйте следующий перечень веществ:
хлорид бария, алюминий, сульфат меди(II), карбонат натрия, разбавленный раствор серной кислоты. Допустимо использование водных растворов веществ.
Возможна следующая реакция:
3H2SO4 + 2Al = Al2(SO4)3 + 3H2↑

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7126.

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7127.
1) SO2 + Br2 + 2H2O = H2SO4 + 2HBr
2) H2SO4 + BaCl2 = BaSO4↓ + 2HCl
3) BaSO4 + 4C = (t°) BaS + 4CO↑
4) CO + CuO = (t°) Cu + CO2
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7443.
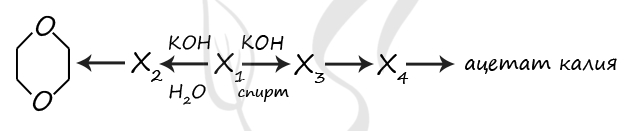
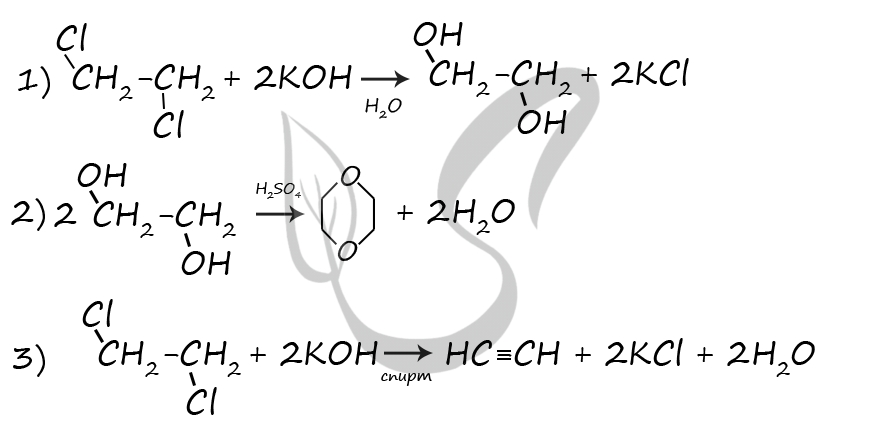
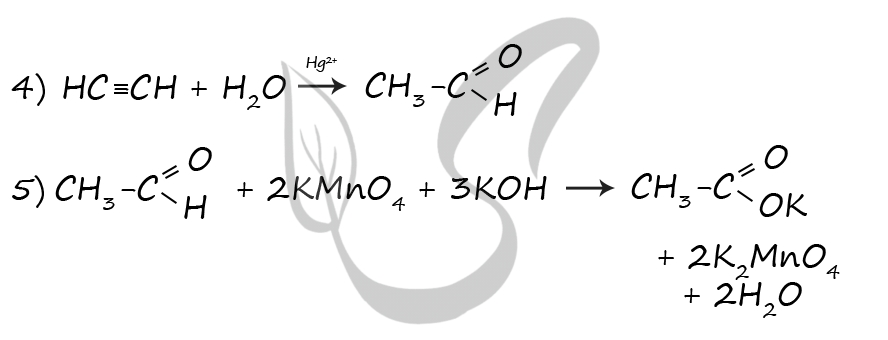
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 20920.
1) Вычислим массовую долю водорода в веществе, и соотношение атомов углерода и водорода
ω(H) = 100 - 87,81 = 12,19
n(C) = ω(H) / M(H) = 87,81 / 12 = 7,3
n(H) = ω(C) / M(C) = 12,19 / 1 = 12,19
Получилось соотношение x : y = 7,3 : 12,19 (делим на наименьшее - 7,3) = 1 : 1.6
Такого вещества нет, включаем химическое мышление. Соотношение 1 к 1.6 то же самое, что 3 к 5.
Однако вещества C3H5 также не существует, поскольку количество атомов водорода должно быть четным. Выход - домножить на два!)
x : y = 3 : 5 (умножаем на 2)
x : y = 6 : 10
Молекулярная формула - C6H10
2) Структурная формула вещества

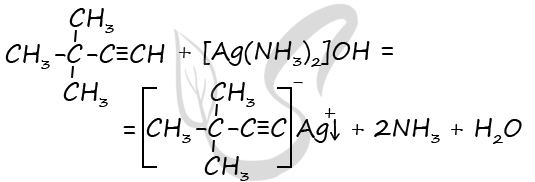
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7796.
I способ решения
1) Пусть М(М) = m(М) = x г, а масса пластинки – у г. Тогда можно составить систему уравнений:
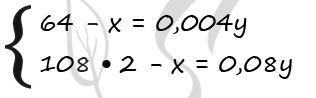
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7410.