


Для выполнения заданий 1-3 используйте следующий ряд химических элементов:
Ответом в заданиях 1-3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Верный ответ: 23
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6782.
Верный ответ: 451
У хлора (4) радиус наибольший, так как данный элемент расположен в 3 периоде, в отличие от углерода и азота, расположенных в 2 периоде. Теперь сравним между собой углерод и азот. Как известно, в периоде радиус атома уменьшается слева направо (с возрастанием числа электронов на внешнем уровне радиус уменьшается, так как электроны притягиваются друг к другу сильнее), значит радиус углерода больше радиуса азота: мы должны расположить: углерод (5) → азот (1).
Итог, радиус атома уменьшается: Cl (4) → C (5) → N (1)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6783.
Верный ответ: 23
Химический секретик :) Металлы не проявляют отрицательную степень окисления. К металлам относятся цинк (2) и титан (3), их и выбираем.
Остальные элементы являются неметаллами, могут проявлять отрицательные степени окисления:
NH3 (аммиак, азот в степени окисления -3)
HCl (соляная кислота и хлориды, хлор в степени окисления -1)
Al4C3 (карбид алюминия, углерод в степени окисления -4)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6784.
Верный ответ: 14
Ионную кристаллическую решетку имеют вещества с ионными связями:
1) NaF - ионная связь → ионная кристаллическая решетка, ионная связь образуется между атомами с большой разницей в электроотрицательности (чаще всего: типичный металл + типичный неметалл)
4) Na2SO4 - между катионами Na+ и анионом SO42- формируется ионная связь → ионная кристаллическая решетка, а внутри аниона SO42-, между S и O находятся ковалентные полярные связи
Остальные пункты:
2) K - металлическая связь (между атомами металла в чистом веществе) → металлическая кристаллическая решетка
3) Br2 - ковалентная неполярная связь между атомами (Br-Br) → молекулярная кристаллическая решетка, атомы имеют одинаковую электроотрицательность → связь неполярная
5) HI - ковалентная полярная связь между атомами (H-I) → молекулярная кристаллическая решетка, между атомами с разной электроотрицательностью → связь полярная
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7310.

Верный ответ: 174
Под цифрами:
1 - хлорид-сульфата железа (III) - смешанная соль (два аниона)
2 - тетрагидроксобириллат калия, комплексная соль (узнаем по наличию комплексного иона в квадратных скобках)
3 - гидросульфат марганца (II) - кислая соль серной кислоты (H2SO4)
4 - хлорид натрия-калия - двойная соль (два катиона)
5 - гидрид лития, бинарное неорганическое соединение металла лития и водорода
6 - нитрид натрия, бинарное неорганическое соединение металла натрия и азота
7 - феррат лития, средняя соль железной кислоты (H2FeO4)
8 - карбонат гидроксомагния (дигидроксокарбонат меди II), основная соль (наличие гидроксид-ионов)
9 - хлорид брома (III), интергалогенид - соединение галогенов между собой
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7871.
1) NaPO3
2) CaCl2
3) Na2HPO4
4) Na3PO4
5) AgNO3
Верный ответ: 45
Вещество X - Na3PO4 (4)
Вещество Y - AgNO3 (5)
В реакциях кислых солей (дигидрофосфат натрия) с основаниями (избыток щёлочи) получаются средние соли
NaH2PO4 + 2NaOH = Na3PO4 + 2H2O
В реакциях между растворимыми солями нитрата серебра и фосфата натрия → получается нерастворимое вещество фосфат серебра - осадок жёлтого цвета
3AgNO3 + Na3PO4 = Ag3PO4↓ + 3NaNO3
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6858.
Верный ответ: 1123
В этом задании скрыты 60 реакций! Правильный подход к его выполнению может значительно повысить ваш уровень знаний неорганической химии.
Итак, ключевой момент: нужно попробовать составить реакцию каждого из веществ (А, Б, В, Г) со всеми предложенными реагентами! Вы должны узнать, возможна ли каждая из этих реакций, или понять причину, по которой она невозможна (например, в реакции не может быть два осадка: и справа, и слева). Следуйте такому подходу, и вы удивитесь, как быстро повысится ваш "неорганический уровень" ;)
Реакции для SO2 протекают так:
SO2 + Ba(OH)2 = BaSO3 + H2O
SO2 + H2O = H2SO3
CaO + SO2 = CaSO3
Реакции для Cl2O7 протекают так:
Cl2O7 + Ba(OH)2 = Ba(ClO4)2 + H2O
Cl2O7 + H2O = 2HClO4
CaO + Cl2O7 = Ca(ClO4)2
Реакции для Na2O протекают так:
Na2O + H2O = 2NaOH
Na2O + H2SO4 = Na2SO4 + H2O
ZnO + Na2O = (t°) Na2ZnO2
Реакции для ZnO протекают так:
ZnO + 2KOH = (t°) K2ZnO2 + H2O
ZnO + 2HCl = ZnCl2 + H2O
ZnO + 2HNO3 = Zn(NO3)2 + H2O
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7279.
Верный ответ: 5132
А) Концентрированная серная кислота является сильным окислителем → окисляет углерод до угольной кислоты, которая неустойчива и сразу же распадается на воду и углекислый газ
C + 2H2SO4 = 2SO2 + CO2 + 2H2O
Б) Углерод является сильным восстановителем, восстанавливает серу до -2
Na2SO4 + 4C = (t°) Na2S + 4CO
В) Разбавленная серная кислота не проявляет окислительных свойств и ведёт себя как самая обычная кислота, поэтому проводим банальную реакцию обмена: все степени окисления сохраняются
Na2S + H2SO4 = Na2SO4 + H2S
Г) В реакции средней соли с соответствующей кислотой образуется кислая соль
Na2SO4 + H2SO4 = 2NaHSO4
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7070.
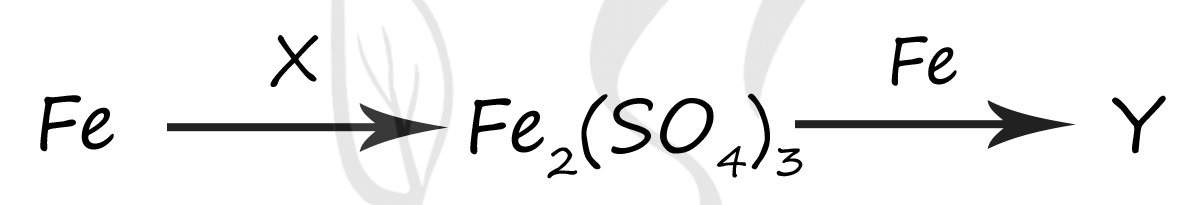
1) FeS
2) H2SO4(конц.)
3) FeSO4
4) H2SO4(разб.)
5) FeSO3
Верный ответ: 23
Вещество X - (2) - H2SO4(конц.)
Концентрированная серная кислота является сильным окислителем который окисляет железо до степени окисления +3, при очень высокой концентрации кислоты побочным продуктом будет сернистый газ
2Fe + 6H2SO4 = Fe2(SO4)3 + 3SO2 + 6H2O
Вещество Y - (3) - FeSO4
Эта реакция относится к реакциям по типу золотой середины: встречаются два атома железа +3 из сульфата железа (III) и железо в степени окисления 0 → промежуточная для них степень окисления будет +2, поэтому образуется сульфат железа (II)
Fe2(SO4)3 + Fe = 3FeSO4
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6966.
Верный ответ: 4421
А) Карбоновые кислоты (пропионовая кислота - C2H5COOH) - общая формула CnH2n+1СООН или CnH2nO2 - наличие карбоксильной группы (группа COOH)
Б) Сложный эфир (этилформиат или этиловый эфир муравьиной кислоты) - общая формула СnH2nO2 - наличие двойной связи между углеродом и кислородом, наличие связи R-O-R'
В) Алкадиены (дивинил - бутадиен-1,3 - C4H6) - общая формула CnH2n-2 - наличие двух двойных связей
Г) Акриловая кислота (CH2=CH-COOH - C3H4O2) - органическое соединение, простейший представитель одноосновных непредельных карбоновых кислот, общая формула CnH2n-2O2

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6862.
Верный ответ: 35
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7703.
Верный ответ: 1345
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6829.
Верный ответ: 34
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7426.
Верный ответ: 5623
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7322.
Верный ответ: 1633
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7918.
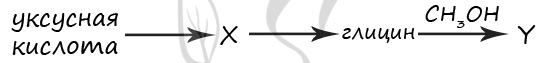
1) ацетилен
2) метиловый эфир уксусной кислоты
3) хлоруксусная кислота
4) ацетат натрия
5) метиловый эфир аминоуксусной кислоты
Верный ответ: 35
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7464.
Верный ответ: 24
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7780.
Верный ответ: 24
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6766.
Верный ответ: 6134
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7327.
Верный ответ: 2143
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7223.
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») - водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.
1) MgSO4
2) HNO3
3) KHCO3
4) Na2SO4
Верный ответ: 2143
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7434.
Верный ответ: 2133
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7470.
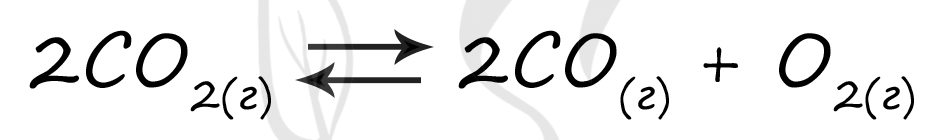
Верный ответ: 56
Таблица (по условиям задания)

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7067.
Верный ответ: 1122
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7821.
Верный ответ: 532
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6947.
Ответом к заданиям 26-28 является число. Запишите это число в поле ответа в тексте работы, соблюдая при этом указанную степень точности. Единицы измерения физических величин указывать не нужно.
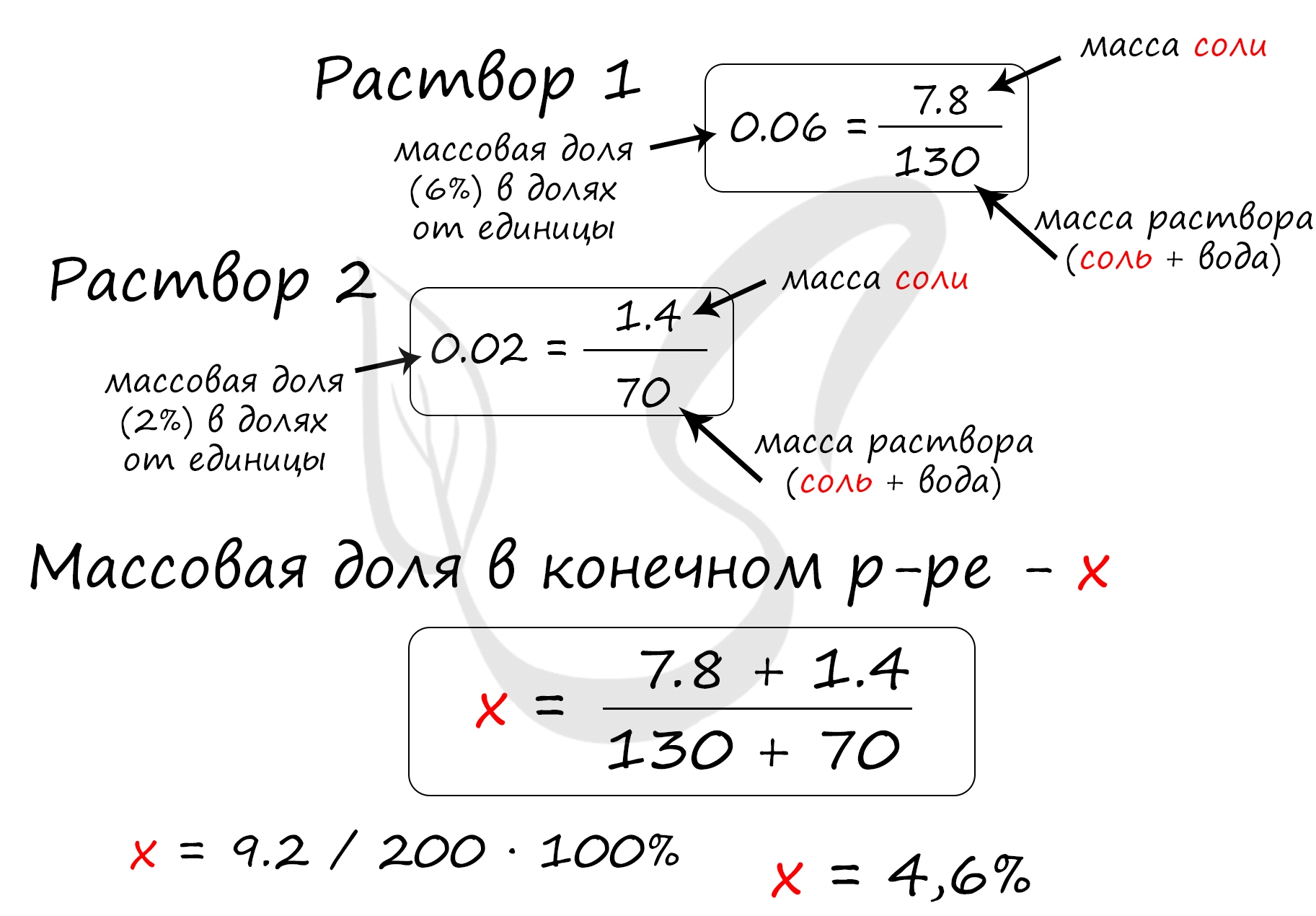
Верный ответ: 4,6
Найдем массу соли, которая присутствует в первом растворе:
m(соли)1 = 130 · 0.06 = 7.8 грамм
Найдем массу соли, которая присутствует во втором растворе:
m(соли)2 = 70 · 0.02 = 1.4 грамм
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7473.
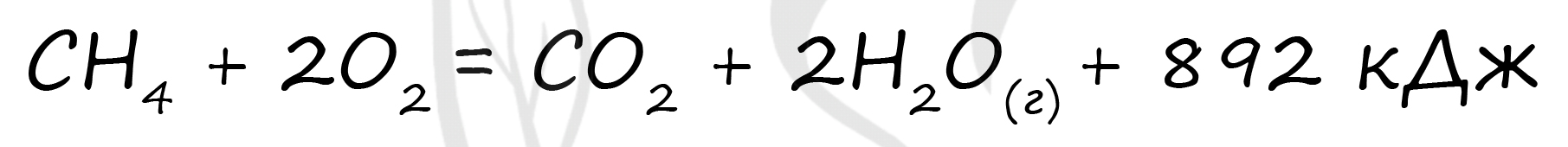
Верный ответ: 3568

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6984.
Верный ответ: 2,5
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
1) n(SO2) = v / Vr = 29,12 л / 22,4 л/моль = 1,3 моль
2) n(FeS2) = 1/2 · n(SO2) = 1/2 · 1,3 = 0,65 моль
3) m(FeS2) = n · Mr = 0,65 моль · 120 г/моль = 78 г
4) w(FeS2) = 78 г / 80 г · 100% = 97,5%
5) w(примесей) = 100% - 97,5% = 2,5%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7615.
Часть 2 Вы проверяете сами. Все пояснения и подсказки к частям 1 и 2 обязательно будут даны по окончании теста.
Для выполнения заданий 29,30 используйте следующий перечень веществ:
дихромат калия, серная кислота, иодид калия, сульфид калия, сульфат калия. Допустимо использование водных растворов веществ.
Возможна следующая реакция:
6KI + K2Cr2O7 + 7H2SO4 = 3I2 + Cr2(SO4)3 + 4K2SO4 + 7H2O

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6846.

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6847.
1) 2HBr + K2CO3 = 2KBr + H2O + CO2↑
2) 2KBr + 2H2O = (ϟ) 2KOH + H2↑ + Br2
3) CuO + H2 = (t°) Cu + H2O
4) Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6883.
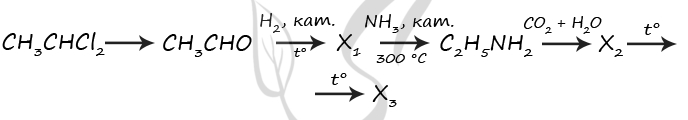
1) CH3CHCl2 + 2KOH = CH3CHO + 2KCl + H2O
2) CH3CHO + H2 = (t°, кат.) CH3CH2OH
3) CH3CH2OH + NH3 = (300 °C, кат.) C2H5NH2 + H2O
4) C2H5NH2 + CO2 + H2O = [C2H5NH3]HCO3 (допустимо образование [C2H5NH3]2CO3)
5) [C2H5NH3]HCO3 = (t°) C2H5NH2 + CO2↑ + H2O
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7584.
1) Формула вещества - CxHy
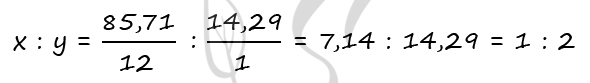
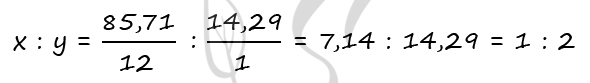
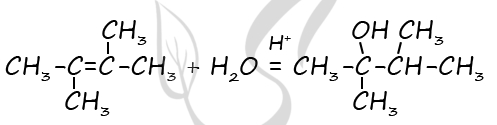
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7271.
1) Уравнения реакций
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
2NaOH + SO2 = Na2SO3 + H2O
2) Вычислим теоретическое количество газа
n(Cu) = m : M = 12,8 : 64 = 0,2 моль
nтеор.(SO2) = n(Cu) = 0,2 моль
3) Вычислим практическое количество газа
mнасыщ. р-ра = 83,16 - 1,26 = 81,9 г
В 130 г р-ра - 30 г соли
В 81,9 г р-ра - х г соли
х = 30 · 81,9 : 130 = 18,9 г
mобщ.(Na2SO3) = 18,9 + 1,26 = 20,16 г
n(Na2SO3) = m : M = 20,16 : 126 = 0,16 моль
nпракт.(SO2) = n(Na2SO3) = 0,16 моль
4) Вычислим выход
η = nпракт.(SO2) : nтеор.(SO2) · 100% = 0,16 : 0,2 · 100% = 80%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6920.