


Для выполнения заданий 1-3 используйте следующий ряд химических элементов:
Ответом в заданиях 1-3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Верный ответ: 12
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7237.
Верный ответ: 354
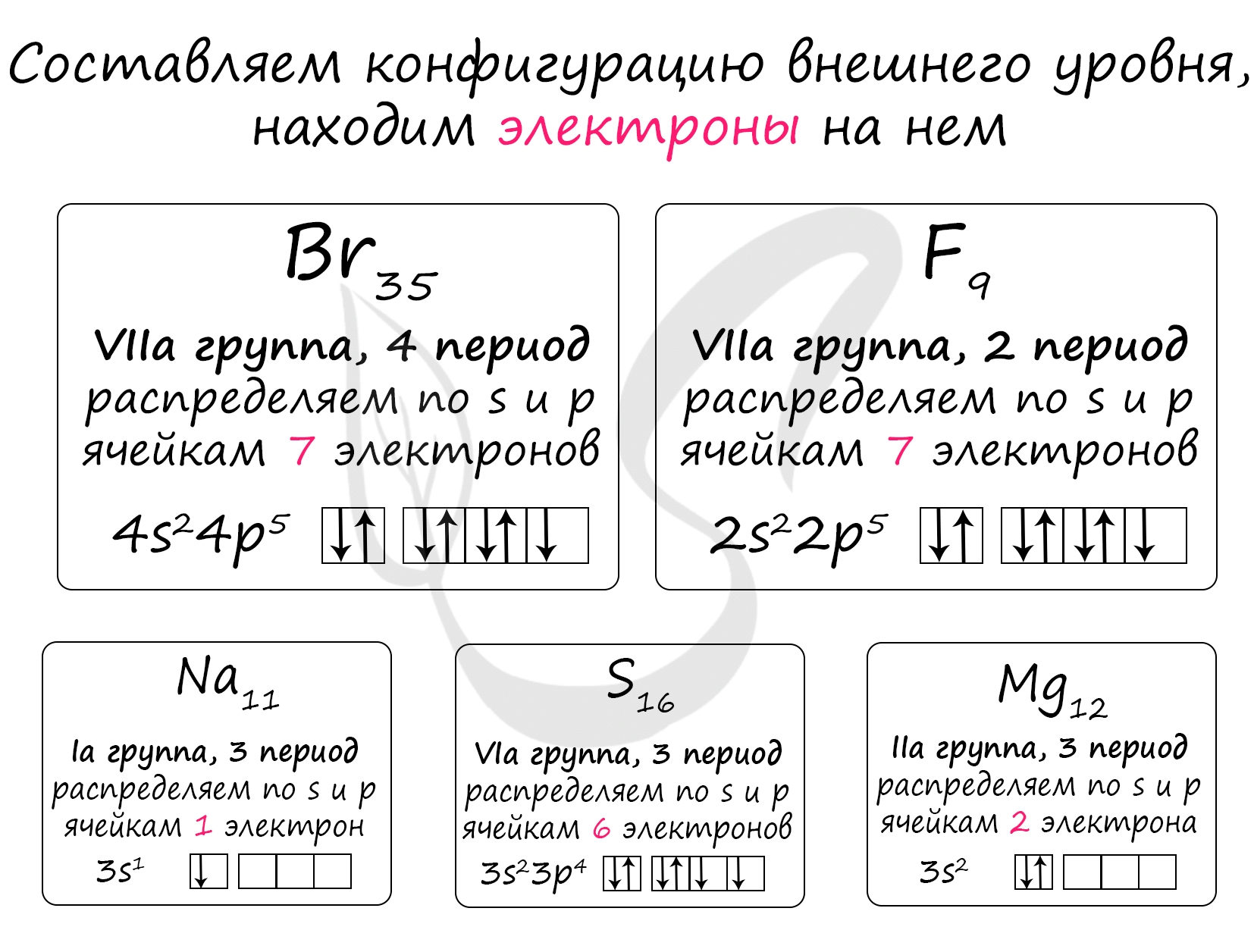
Энергия ионизации - наименьшая энергия, которая необходима для удаления электрона от свободного атома в его низшем энергетическом (основном) состоянии на бесконечность. От энергии ионизации в значительной степени зависит прочность связи, а значит мы проассоциируем ее с электроотрицательностью (проще говоря, грубо и прагматично: электроотрицательность = энергия ионизации = энергия связи)
Все выбранные элементы находятся в 3 периоде. В периоде электроотрицательность ( = прочность связи = энергия ионизации) увеличивается слева направо (→ - по направлению к F)
Теперь располагаем все элементы в порядке возрастания их электроотрицательности (= первой энергии ионизации): Na (3) → Mg (5) → S (4)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7238.
Верный ответ: 12
Образуют соединения в степени окисления -1:
1) Br - степени окисления -1 (HBr), +1 (Br2O), +3 (Br2O3), +5 (Br2O5), +7 (Br2O7)
2) F - постоянная степень окисления -1 (HF)
Остальные пункты:
3) Na - постоянная степень окисления +1
4) S - степени окисления -2 (H2S), +4 (SO2), +6 (SO3)
5) Mg - постоянная степень окисления +2 (MgO)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7239.
Верный ответ: 45
Ионная связь присутствует в молекулах
4) Na2O - ионная связь, образуется между атомами с большой разницей в электроотрицательности (чаще всего: типичный металл + типичный неметалл)
5) NaCl - ионная связь, образуется между атомами с большой разницей в электроотрицательности (чаще всего: типичный металл + типичный неметалл)
Остальные пункты:
1) SO2 - ковалентные полярные связи (S-O), между атомами неметаллов с разной электроотрицательностью → связь полярная
2) NH3 - ковалентные полярные связи (N-H)
3) HCl - ковалентные полярные связи (H-Cl)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7520.

Верный ответ: 176
Под цифрами:
1 - формиат аммония (аммоний муравьинокислый) - соль муравьиной кислоты (органическая одноосновная слабая кислота - HCOOH)
2 - гидросульфид натрия - кислая соль сероводородной кислоты (H2S)
3 - оксид кремния (II) - несолеобразующий оксид
4 - селеноводород (гидрид селена, селенистоводородная кислота)
5 - оксид кальция (II) проявляет основные свойства, соответствует основанию Ca(OH)2
6 - слабая двухосновная кислота, неустойчивая → сразу же распадается на воду и углекислый газ
7 - оксид азота (IV) - кислотный оксид, соответствует сильной одноосновной азотной кислоте (HNO3) и слабой одноосновной азотистой кислоте (HNO2)
8 - оксид марганца (IV) проявляет амфотерные свойства: реагирует как с кислотами, так и с основаниями
9 - бромид-хлорид магния - смешанная соль (два аниона)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7556.

1) сероводород
2) карбонат меди(II)
3) сульфид калия
4) сульфит калия
5) сульфат меди(II)
Верный ответ: 35
Не выбираем сероводород (1), так как это слабый электролит и его нельзя раскладывать на ионы, а по условию в исходных веществах у нас газа нет. Не выбираем карбонат меди (II) (2), так как это осадок, а осадков по условию в исходных веществах также нет.
Не выбираем сульфит калия (4), так как по условиям реакция идёт с сульфидом.
Вещество X - K2S (3)
Вещество Y - CuSO4 (5)
В результате реакции обмена между сульфидом калия и сульфатом меди (II) → образуется сульфат калия и осадок чёрного цвета - сульфид меди (II)
CuSO4 + K2S = CuS↓ + K2SO4
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7768.
Верный ответ: 5432
В этом задании скрыты 60 реакций! Правильный подход к его выполнению может значительно повысить ваш уровень знаний неорганической химии.
Итак, ключевой момент: нужно попробовать составить реакцию каждого из веществ (А, Б, В, Г) со всеми предложенными реагентами! Вы должны узнать, возможна ли каждая из этих реакций, или понять причину, по которой она невозможна (например, в реакции не может быть два осадка: и справа, и слева). Следуйте такому подходу, и вы удивитесь, как быстро повысится ваш "неорганический уровень" ;)
Реакции для CaBr2 протекают так:
CaBr2 + Cl2 = CaCl2 + Br2
CaBr2 + Na2CO3 = CaCO3 + 2NaBr
3CaBr2 + 2K3PO4 = Ca3(PO4)2 + 6KBr
Реакции для NaOH протекают так:
2NaOH + ZnSO4 = Zn(OH)2 + Na2SO4
2NaOH + CuCl2 = Cu(OH)2 + 2NaCl
NaOH + NaHCO3 = Na2CO3 + H2O
Реакции для P2O5 протекают так:
P2O5 + 3Ba(OH)2 = Ba3(PO4)2 + 3H2O
P2O5 + 3K2O = 2K3PO4
P2O5 + 3H2O = 2H3PO4
Реакции для Fe протекают так:
Fe + CuSO4 = FeSO4 + Cu (железо, как более активный металл, вытесняет медь)
4Fe + 3O2 = 2Fe2O3
Fe + 2HCl = FeCl2 + H2
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7489.
Верный ответ: 2341
А) Реакция между гидроксидом калия и хлором при нагревании (!) идёт до образования хлората калия и хлорида калия (без нагревания образуется гипохлорит и хлорид калия)
3Cl2 + 6KOH = (t°) 5KCl + KClO3 + 3H2O
Б) Без нагревания в аналогичной реакции (см пункт А) образуется гипохлорит и хлорид калия
Cl2 + 2KOH = (0 °C) KCl + KClO + H2O
В) Разложение бертолетовой соли (KClO3) в присутствии катализатора приводит к образованию хлорида калия и кислорода
2KClO3 = (t°, кат.) 2KCl + 3O2
Г) Разложение бертолетовой соли (KClO3) в отсутствии катализатора идёт по типу диспропорционирования: хлор одновременно является и окислителем, и восстановителем
KClO3 = (t°) KCl + KClO4
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7035.

1) гидроксид натрия
2) аммиак
3) хлорид аммония
4) вода
5) сульфат аммония
Верный ответ: 21
Вещество X - (2) - HNO3
Аммиак обладает основными свойствами и вступает в реакцию с азотной кислотой с образованием нитрата аммония (основание + кислота = соль)
NH3 + HNO3 = NH4NO3
Вещество Y - (1) - NaOH
В результате реакции обмена между гидроксидом натрия и нитратом аммония → образуется нитрат натрия и гидроксид аммония, который неустойчив и сразу же распадается на аммиак и воду
NH4NO3 + NaOH = NaNO3 + NH3 + H2O
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7281.
Верный ответ: 3214
А) Алкадиены (3-метилгексадиен-1,4) - общая формула CnH2n-2 - наличие двух двойных связей
Б) Алкены (5-метилгексен-1) - общая формула CnH2n - наличие одной двойной связи
В) Алканы (2,3-диметилбутан) - общая формула CnH2n+2 - насыщенные (предельные) углеводороды, нет двойных/тройных связей
Г) Алкины (2-метилгексин-3) - общая формула CnH2n-2 - наличие одной тройной связи
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7807.
Верный ответ: 34
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7738.
Верный ответ: 34
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7039.
Верный ответ: 14
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7181.
Верный ответ: 1332
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6867.
Верный ответ: 3612
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7113.
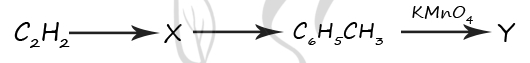
1) C6H13COOH
2) C6H6
3) C6H5OH
4) C6H10
5) C6H5COOH
Верный ответ: 25
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7604.
Верный ответ: 12
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7815.
Верный ответ: 13
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6941.
Верный ответ: 432
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6837.
Верный ответ: 3444
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7573.
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») - водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.
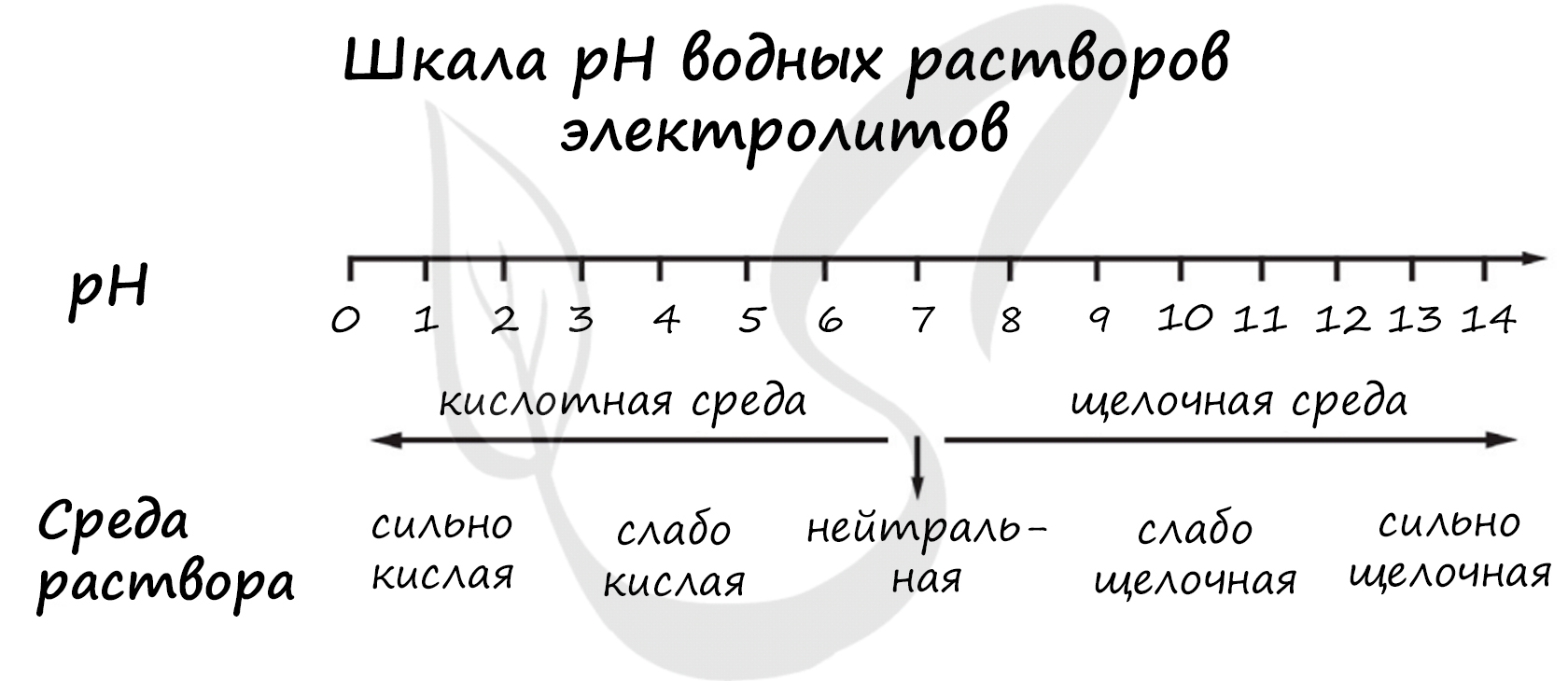
1) HIO3
2) HBrO
3) Ba(NO3)2
4) KHSO3
Верный ответ: 1234
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7469.
Верный ответ: 2132
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7435.
Верный ответ: 11
Таблица (по условиям задания)
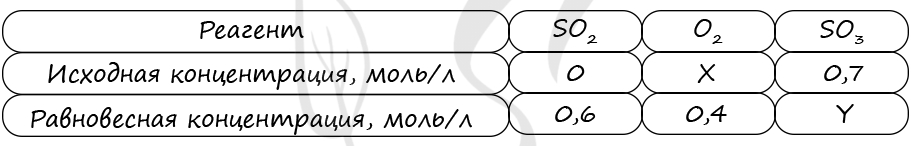
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6892.
Верный ответ: 3314
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7366.
Верный ответ: 134
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6772.
Ответом к заданиям 26-28 является число. Запишите это число в поле ответа в тексте работы, соблюдая при этом указанную степень точности. Единицы измерения физических величин указывать не нужно.
Верный ответ: 17
Найдем массу соли, которая присутствует в первом растворе:
m(соли)1 = 120 · 0.15 = 18 грамм
Найдем массу соли, которая присутствует во втором растворе:
m(соли)2 = 80 · 0.2 = 16 грамм
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7543.

Верный ответ: 13,44

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7404.
Верный ответ: 46
K2CO3 + 2HNO3 = 2KNO3 + H2O + CO2↑
1) n(CO2) = v / Vr = 10,08 л / 22,4 л/моль = 0,45 моль
2) n(K2CO3) = n(CO2) = 0,45 моль
3) m(K2CO3) = n · Mr = 0,45 моль · 138 г/моль = 62,1 г
4) w(K2CO3) = 62,1 г / 115 г · 100% = 54%
5) w(примесей) = 100% - 54% = 46%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7685.
Часть 2 Вы проверяете сами. Все пояснения и подсказки к частям 1 и 2 обязательно будут даны по окончании теста.
Для выполнения заданий 29,30 используйте следующий перечень веществ:
нитрат магния, дихромат калия, ортофосфат натрия, серная кислота (разб.), бромид калия. Допустимо использование водных растворов веществ.
Возможна следующая реакция:
K2Cr2O7 + 6KBr + 7H2SO4 = 3Br2 + Cr2(SO4)3 + 7H2O + 4K2SO4

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7336.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7337.
1) ZnS + H2SO4 = ZnSO4 + H2S↑
2) 2ZnS + 3O2 = 2ZnO + 2SO2↑
3) 2H2S + SO2 = 3S↓ + 2H2O
4) S + 6HNO3 = H2SO4 + 6NO2↑ + 2H2O
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7548.

1) C2H5Cl + CH3Cl + Mg = MgCl2 + CH3-CH2-CH3 (допустимо использовать Na)
2) CH3-CH2-CH3 = (t°, Pt) H3C-CH=CH2 + H2
3) 3H3C-CH=CH2 + 2KMnO4 + 4H2O = 3H3C-CH(OH)-CH2(OH) + 2MnO2 + 2KOH
4) H3C-CH(OH)-CH2(OH) + 2HBr = H3C-CH(Br)-CH2(Br) + 2H2O
5) H3C-CH(Br)-CH2(Br) + 2KOH(спирт.) = (t°) H3C-C≡CH + 2KBr + 2H2O
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7829.
Общая формула вещества A - CxHyOzNm
1) Найдем массовую долю атомов углерода
ω(C) = 100 - 13,58 - 31,03 - 8,80 = 46,59%
x : y : z : m = (46,59 / 12) : (8,8 / 1) : (31,03 / 16) : (13,58 : 14)
Соотношение атомов в молекуле x : y : z : m = 4 : 9 : 2 : 1
Молекулярная формула вещества А - C4H9O2N
2) Структурная формула
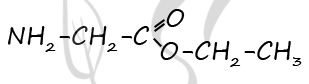
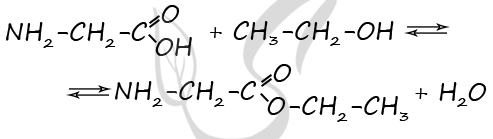
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7586.
1) Уравнения реакций
Cu + 2H2SO4 = CuSO4 + SO2↑ + 2H2O (1)
CuO + H2SO4 = CuSO4 + H2O (2)
NaOH + SO2 = NaHSO3 (3)
2) Вычислим массу CuO
m(NaOH) = 200 ⋅ 0,1 = 20 г
n(NaOH) = 20 : 40 = 0,5 моль
n(NaOH) = n(SO2) = n(Cu) = 0,5 по уравнению 1 и 3
m(Cu) = 0,5 ⋅ 64 = 32 г
Примем x = n(CuO) = n(Cu)в CuO, тогда
m(Cu)в CuO = x ⋅ 64 = 64x (г)
m(CuO) = x ⋅ 80 = 80x (г)
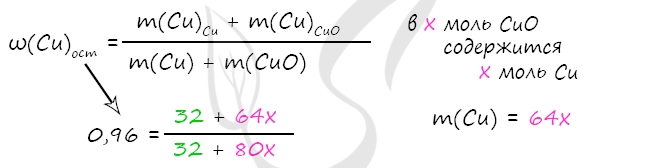
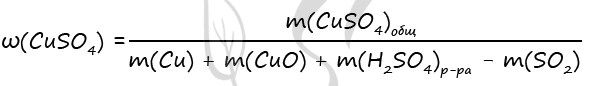
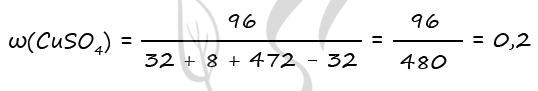
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7900.