


Для выполнения заданий 1-3 используйте следующий ряд химических элементов:
Ответом в заданиях 1-3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Верный ответ: 35
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6887.
Верный ответ: 143
Валентности высших гидроксидов в порядке уменьшения:
(1) HMnO4 (VII) - выглядит как кислота, но можно записать в виде кислотного гидроксида MnO3(OH)
(4) Al(OH)3 (III)
(3) Be(OH)2 (II)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6888.
Верный ответ: 34
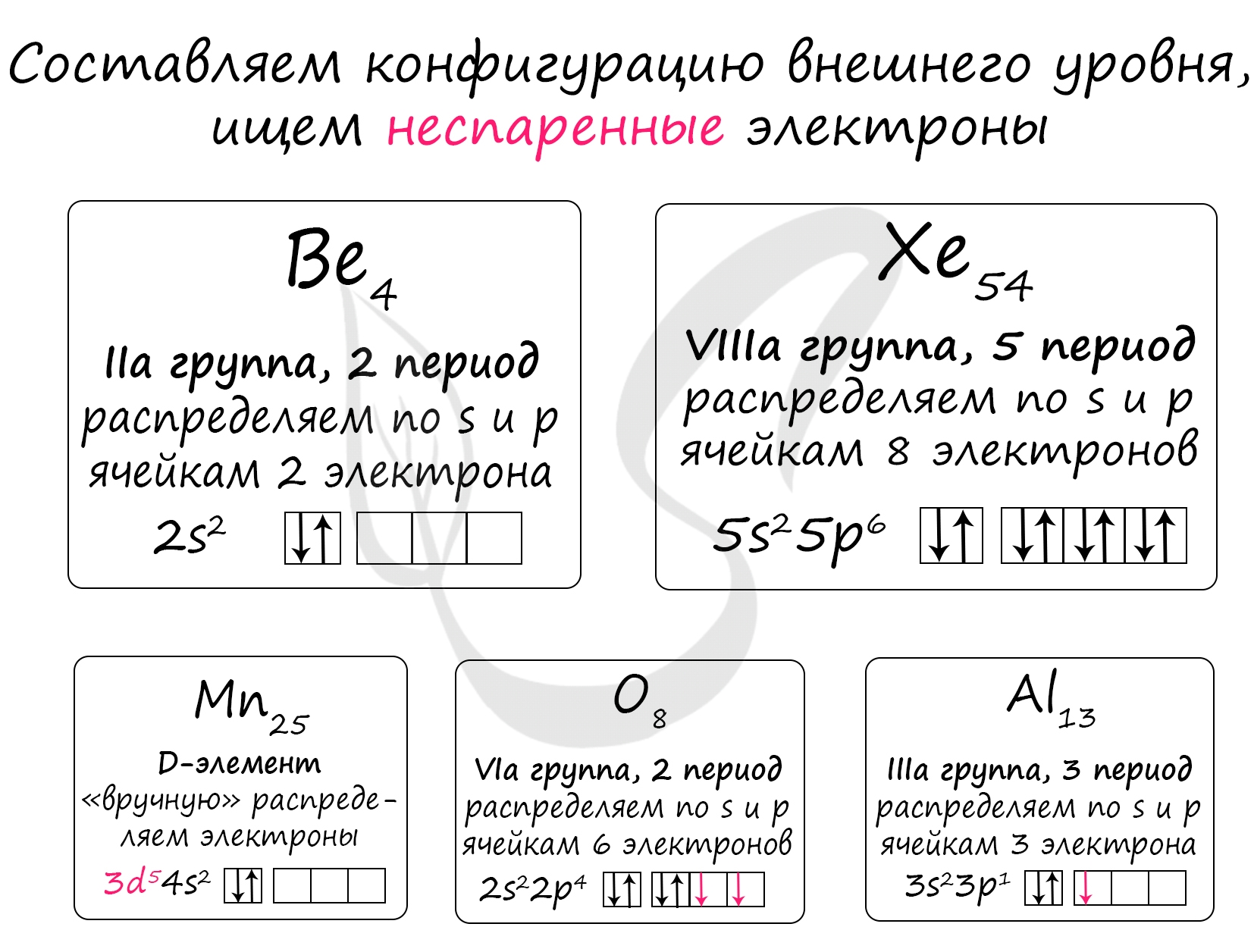
Проявляют постоянную степень окисления:
3) Be - во всех соединениях +2 (BeO)
4) Al - во всех соединениях +3 (Al2O3)
Остальные пункты:
1) Mn - принимает степени окисления +2 (MnO), +3 (Mn2O3), +4 (MnO2), +6 (H2MnO4), +7 (HMnO4)
2) O - наиболее типичная степень окисления -2 (CaO), но также принимает -1 (пероксиды - Na2O2) и +2 (фторид кислорода - OF2)
5) Xe - принимает степени окисления +1, +2, +4, +6, +8
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6889.
Верный ответ: 25
Ионная химическая связь отсутствует в
2) HNO3 - только ковалентные полярные связи (H-O, N-O), между атомами с разной электроотрицательностью → связь полярная
5) HCl - только ковалентные полярные связи (H-Cl), между атомами с разной электроотрицательностью → связь полярная
Остальные пункты:
1) NH4Br - между катионами NH4+ и анионом Br- формируется ионная связь, а внутри катиона NH4+, между N и H находятся ковалентные полярные связи
3) BaCl2 - ионная связь, образуется между атомами с большой разницей в электроотрицательности (чаще всего: типичный металл + типичный неметалл)
4) CaO - ионная связь, образуется между атомами с большой разницей в электроотрицательности (чаще всего: типичный металл + типичный неметалл)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7205.
Верный ответ: 789
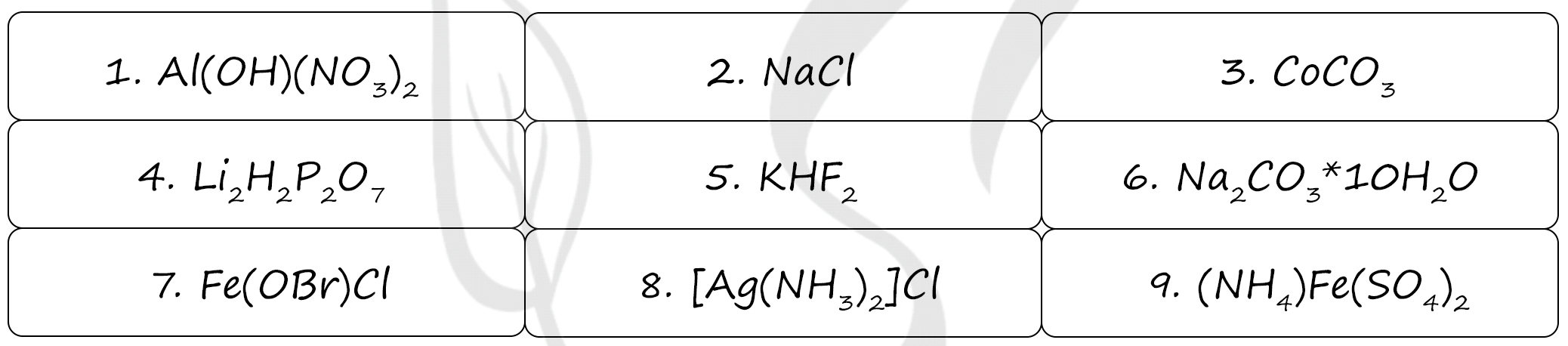
Под цифрами:
1 - гидроксонитрат алюминия, основная соль (наличие гидроксид-ионов)
2 - хлорид натрия - соль соляной кислоты (HCl) - одноосновная сильная кислота, образует только средние соли (кислые соли образуют многоосновные кислоты)
3 - карбонат кобальта (II) - соль угольной кислоты (H2CO3) - двухосновная сильная кислота, если бы была кислая соль - Co(HCO3)2
4 - дигидропирофосфат лития, кислая соль пирофосфорной кислоты (H4P2O7)
5 - гидрофторид калия, кислая соль калия и фтористоводородной кислоты (HF)
6 - кристаллогидрат (наличие молекул воды) карбоната натрия, медный купорос
7 - хлорид-гипобромита железа (II) - смешанная соль (два аниона)
8 - хлорид диамминсеребра(I), комплексная соль (узнаем по наличию комплексного иона в квадратных скобках)
9 - сульфат железа-аммония - двойная соль (два катиона)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7381.

1) FeS
2) Na2S
3) HBr
4) H2S
5) K2SO3
Верный ответ: 23
Не выбираем сульфид железа (1), так как по условию в исходных веществах у нас нет осадков. Не выбираем сероводород (4), так как это слабый электролит и его нельзя раскладывать на ионы, а по условию в исходных веществах у нас нет газа.
Сульфит калия (5) не выбираем, так как нам требуется сульфид.
Вещество X - Na2S (2)
Вещество Y - HBr (3)
В результате реакции обмена между сульфидом натрия и бромоводородной кислотой → образуется бромид натрия и сероводород - газ с неприятным запахом тухлых яиц
Na2S + 2HBr = 2NaBr + H2S↑
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7698.
Верный ответ: 2212
А) CaCO3 - нерастворимая соль, соответственно реакция с другими солями не будет характерна. Однако не будем забывать, что нерастворимые соли хорошо растворяются в сильных кислотах:
CaCO3 + H2SO4 = CaSO4 + H2O + CO2↑
Б) KHS - не вступает в реакцию обмена с хлоридом калия и бромидом натрия, так как образующиеся (в теории) соединения растворимы; не реагирует с H2SiO3 так как H2SiO3 - слабая нерастворимая кислота
2KHS + H2SO4 = K2SO4 + 2H2S↑
В) CuSO4 - растворимая соль, которая образует осадок чёрного цвета - сульфид меди (II), при реакции с сероводородом; не вступает в реакцию обмена с хлоридом калия и бромидом натрия, так как образующиеся (в теории) соединения растворимы; не реагирует с H2SiO3, так как H2SiO3 - слабая нерастворимая кислота
CuSO4 + H2S = CuS↓ + H2SO4
Г) BaCl2 - растворимая соль, которая образует осадок белого цвета - сульфат бария (II), при реакции с серной кислотой; не вступает в реакцию обмена с хлоридом калия и бромидом натрия, так как образующиеся (в теории) соединения растворимы; не реагирует с H2SiO3, так как H2SiO3 - слабая нерастворимая кислота
BaCl2 + H2SO4 = BaSO4↓ + 2HCl
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7314.
Верный ответ: 6524
А) В реакции основного оксида и кислоты → образуется соль данной кислоты и вода
CaO + H2SO4 = CaSO4 + H2O
Б) В данном случае серную кислоту следует понимать как разбавленную, а значит она не проявляет окислительных свойств и ведёт себя как самая обычная кислота → поэтому кальций вытесняет водород (поскольку кальций активнее водорода и стоит в ряду напряжений левее водорода)
Ca + H2SO4 = CaSO4 + H2
В) Концентрированная серная кислота проявляет окислительные свойства и в реакции с активным металлом кальцием → будет образовывать газообразный продукт, где сера будет в наименьшей степени окисления, именно поэтому мы выбираем пункт 2, в котором находится сероводород (сера в степени окисления -2)
4Ca + 5H2SO4 = 4CaSO4 + H2S + 4H2O
Г) При реакции основного оксида с кислотным образуется соль кислоты, которой соответствует кислотный оксид; изменение степеней окисления не происходит: следует сохранить степень окисления серы +6 и именно поэтому образуется сульфат (где сера +6)
CaO + SO3 = CaSO4
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7910.
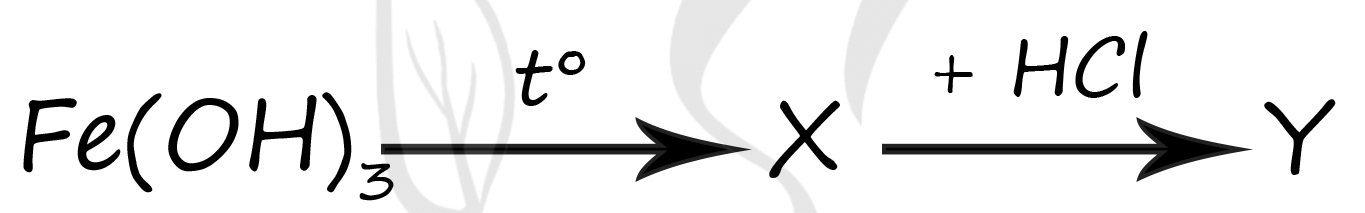
1) FeCl3
2) FeO
3) Fe2O3
4) FeCl2
5) Fe(OH)3
Верный ответ: 31
Вещество X - (3) - Fe2O3
Нерастворимые гидроксиды при термическом разложении легко отдают воду и образуют оксид металла в соответствующей степени окисления (+3)
2Fe(OH)3 = Fe2O3 + 3H2O
Вещество Y - (1) - FeCl3
Происходит обычная реакция обмена, в которой никто степени окисления не меняет, поэтому образуется именно хлорид железа (III)
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7526.
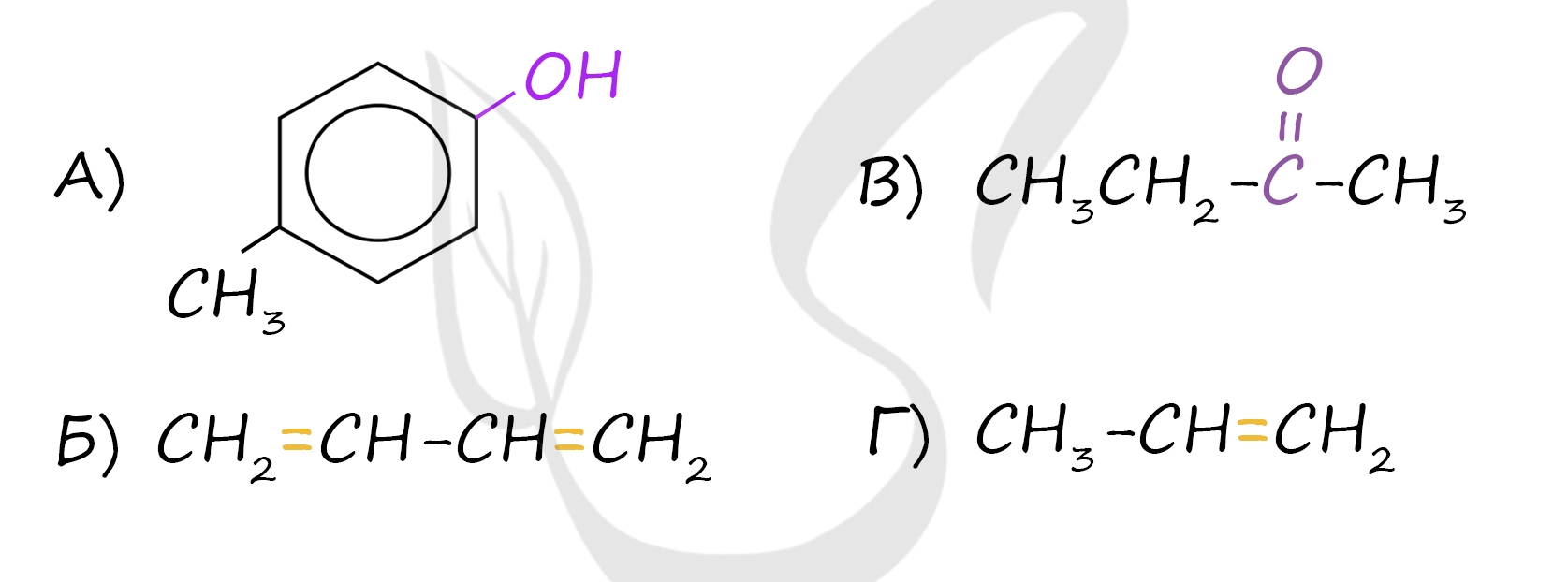
Верный ответ: 2143
А) Фенолы (крезол - метилфенол) - общая формула CnH2n-7OH или CnH2n-6O - наличие гидроксильной группы (OH), которая связана с бензольным кольцом
Б) Алкадиены (бутадиен-1,3) - общая формула CnH2n-2 - наличие двух двойных связей
В) Кетоны (бутанон) - общая формула R−(C=O)−R' - наличие карбонильной группы (С=O) у вторичного атома углерода
Г) Алкены (пропен) - общая формула CnH2n - наличие одной двойной связи
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6897.
Верный ответ: 23
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7773.
Верный ответ: 1235
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7564.
Верный ответ: 34
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7391.
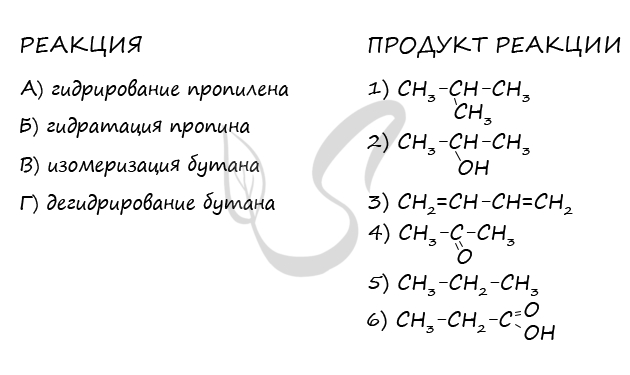
Верный ответ: 5413
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7567.
Верный ответ: 6513
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7218.

1) бром
2) этан
3) бромид калия
4) бромоводород
5) этанол
Верный ответ: 54
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7149.
Верный ответ: 14
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7920.
Верный ответ: 12
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7816.
Верный ответ: 224
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6802.
Верный ответ: 2342
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7083.
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») - водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.
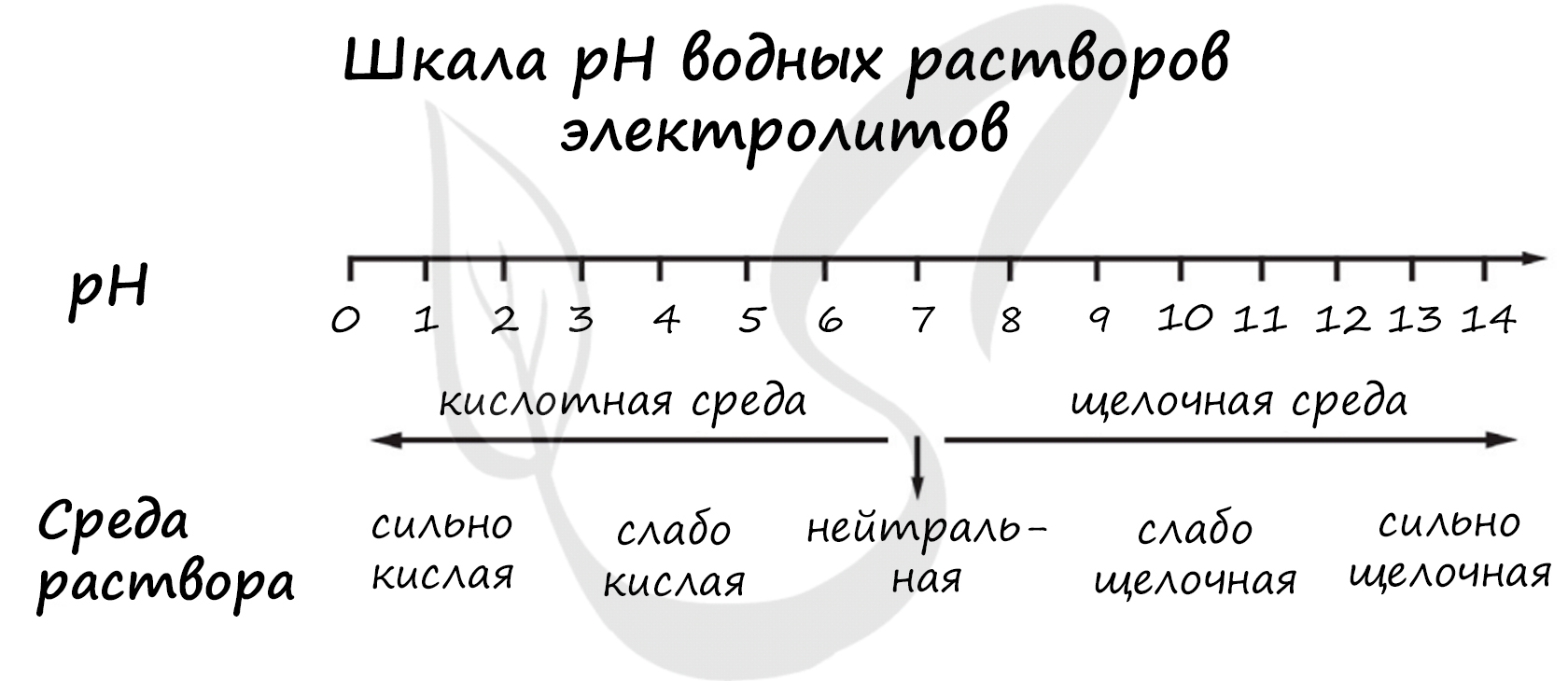
1) гидросульфид натрия
2) периодат калия
3) сульфид натрия
4) хлорид цинка
Верный ответ: 3124
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6839.
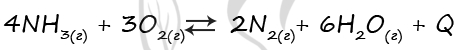
Верный ответ: 1121
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7540.
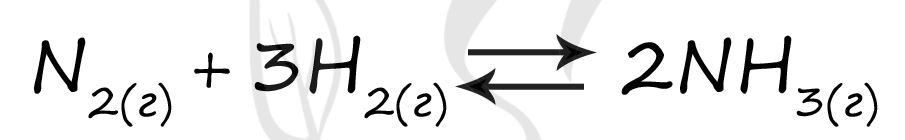
Верный ответ: 65
Таблица (по условиям задания)

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7312.
Верный ответ: 1425
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7611.
Верный ответ: 231
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7507.
Ответом к заданиям 26-28 является число. Запишите это число в поле ответа в тексте работы, соблюдая при этом указанную степень точности. Единицы измерения физических величин указывать не нужно.
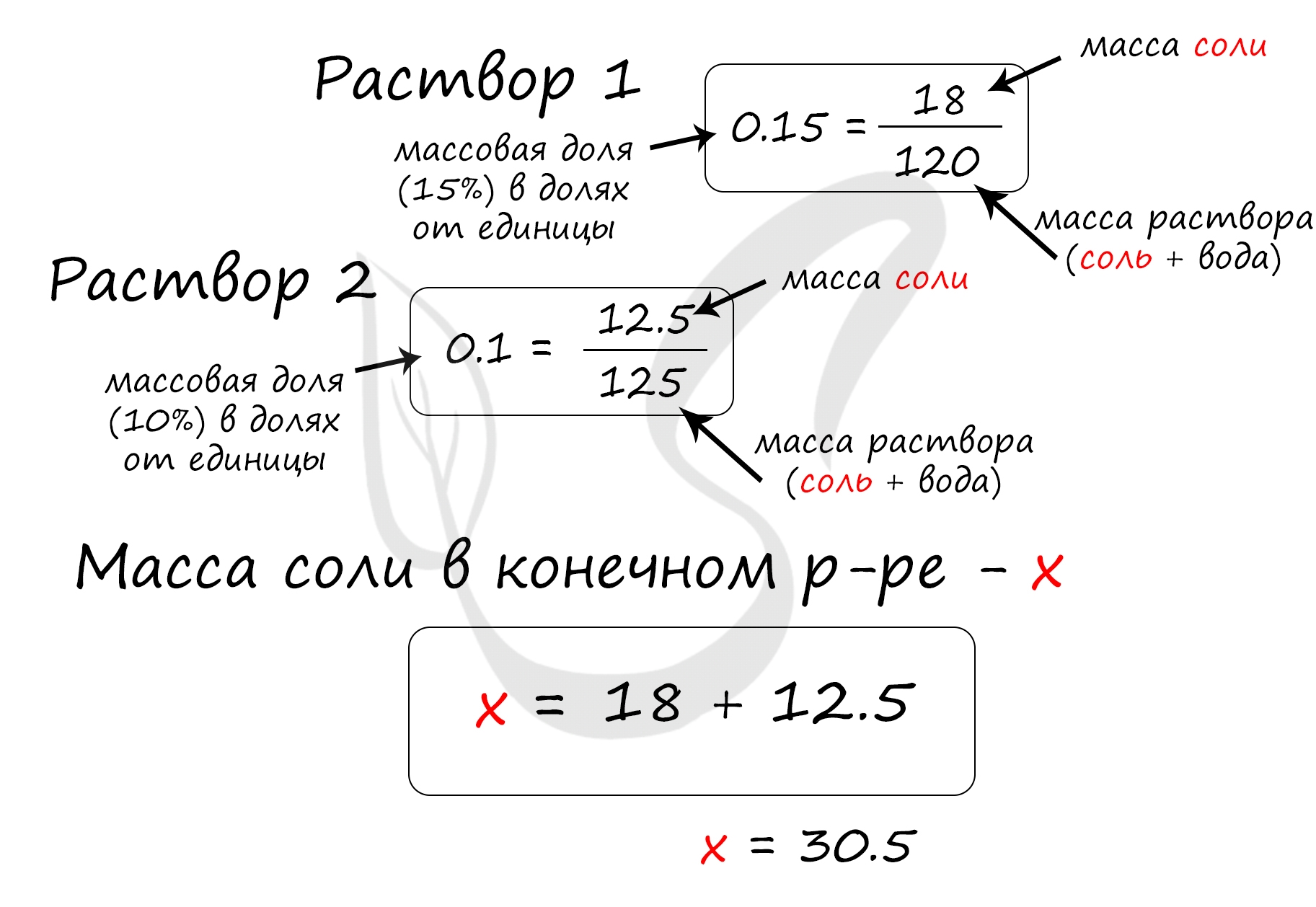
Верный ответ: 30,5
Найдем массу соли, которая присутствует в первом растворе:
m(соли)1 = 120 · 0.15 = 18 грамм
Найдем массу соли, которая присутствует во втором растворе:
m(соли)2 = 125 · 0.1 = 12.5 грамм
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7648.
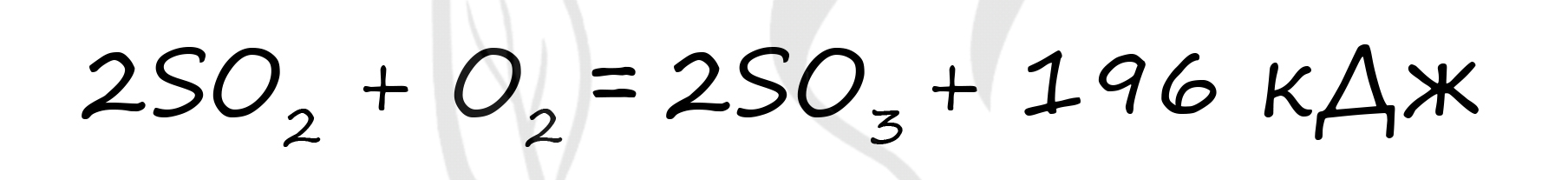
Верный ответ: 39,2

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6774.
Верный ответ: 98
2KClO3 → (кат.) 2KCl + 3O2
1) n(O2) = v / Vr = 20160 л / 22,4 л/моль = 900 моль
2) n(KClO3) = 2/3 · n(O2) = 2/3 · 900 = 600 моль
3) m(KClO3) = n · Mr = 600 моль · 122,5 г/моль = 73 500 г = 73,5 кг
4) w(KClO3) = 73,5 кг / 75 кг · 100% = 98%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6810.
Часть 2 Вы проверяете сами. Все пояснения и подсказки к частям 1 и 2 обязательно будут даны по окончании теста.
Для выполнения заданий 29,30 используйте следующий перечень веществ:
иодид калия, гидроксид алюминия, сульфат меди(II), сульфид натрия, соляная кислота. Допустимо использование водных растворов веществ.
Возможна следующая реакция:
2CuSO4 + 4KI = 2K2SO4 + 2CuI↓ + I2↓

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7056.

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7057.
1) AlP + 3HNO3 = Al(NO3)3 + PH3↑
2) PH3 + 4Br2 + 11NaOH = Na3PO4 + 7H2O + 8NaBr
3) 2Na3PO4 + 3Ca(OH)2 = Ca3(PO4)2↓ + 6NaOH
4) Ca3(PO4)2 + 4H3PO4 = (t°) 3Ca(H2PO4)2
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7163.

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7864.
1) Общая формула вещества - СxHyOz
n(CO2) = 8,96 : 22,4 = 0,4 моль
n(H2O) = 5,4 : 18 = 0,3 моль
M(СxHyOz) = 1,227 ⋅ 44 = 54 г/моль
n(СxHyOz) = 2,24 : 22,4 = 0,1 моль
n(C) = n(CO2) = 0,4 моль
n(H) = 2n(H2O) = 0,6 моль
m(C) + m(H) = 0,4 ⋅ 12 + 0,6 ⋅ 1 = 5,4 г (кислород отсутствует)
x = n(C) / n(СxHyOz) = 0,4 / 0,1 = 4
y = n(H) / n(СxHyOz) = 0,6 / 0,1 = 6
Молекулярная формула C4H6
2) Структурная формула HC≡C-CH2-CH3
3) Уравнение реакции этого вещества с избытком бромной воды:
HC≡C-CH2-CH3 + 2Br2(водн.) = CH(Br2)-C(Br2)-CH2-CH3
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7166.
1) Уравнения реакций:
2KCl + 2H2O = 2KOH + H2 + Cl2 (1)
2H2O = 2H2 + O2 (2)
4KOH + P2O5 = 2K2HPO4 + H2O (3)
2) Вычислим количества исходных веществ
m(KCl) = mр-ра · ω(KCl) = 80 · 0,25 = 20 г
n(KCl) = m : M = 20 : 74,5 = 0,268 моль
nобщ.(H2) = V : Vm = 8,96 : 22,4 = 0,4 моль
n(P2O5) = m : M = 9,514 : 142 = 0,067 моль
3) Вычислим количества соли калия и веществ, образовавшихся при электролизе
Если весь KCl вступит в реакцию (1), то выделится 0,134 моль водорода < 0,4 моль ⇒ начнется электролиз воды
n(KOH) = n(KCl) = 0,268 моль
n1(H2) = n1(Cl2) = 0,5n(KOH) = 0,134 моль
n2(H2) = nобщ.(H2) - n1(H2) = 0,4 - 0,134 = 0,266 моль
n(O2) = 0,5n2(H2) = 0,133 моль
n(KOH) : n(P2O5) = 0,268 : 0,067 = 4 : 1 ⇒ образуется гидрофосфат калия (коэфф.4 и 1)
n(K2HPO4) = 0,5n(KOH) = 0,134 моль
4) Вычислим массу выпавшего осадка
m(K2HPO4) = n · M = 0,134 · 174 = 23,316 г
mр-ра = mр-ра(KCl) - m(H2) - m(Cl2) - m(O2) + m(P2O5) = 80 - 2 · 0,4 - 71 · 0,134 - 0,133 · 32 + 9,514 = 74,94 г
m(H2O) = mр-ра - m(K2HPO4) = 74,94 - 23,316 = 51,624 г
В 100 г воды - 25 г соли
В 51,624 г воды - x г соли
x = 12,9 г = mраств.(K2HPO4)
m↓(K2HPO4) = m(K2HPO4) - mраств. = 23,316 - 12,9 = 10,416 г
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6885.