


Для выполнения заданий 1-3 используйте следующий ряд химических элементов:
Ответом в заданиях 1-3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Верный ответ: 45
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7377.
Верный ответ: 253
Выбранные элементы находятся в одном и том же периоде - 3. В периоде увеличение радиуса атома происходит справа налево (←), поскольку чем меньше электронов на внешнем уровне, тем радиус атома БОЛЬШЕ: электроны меньше притягиваются друг к другу и чувствуют себя более свободно :)
Радиус атома увеличивается: S (2) → P (5) → Mg (3)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7378.
Верный ответ: 45
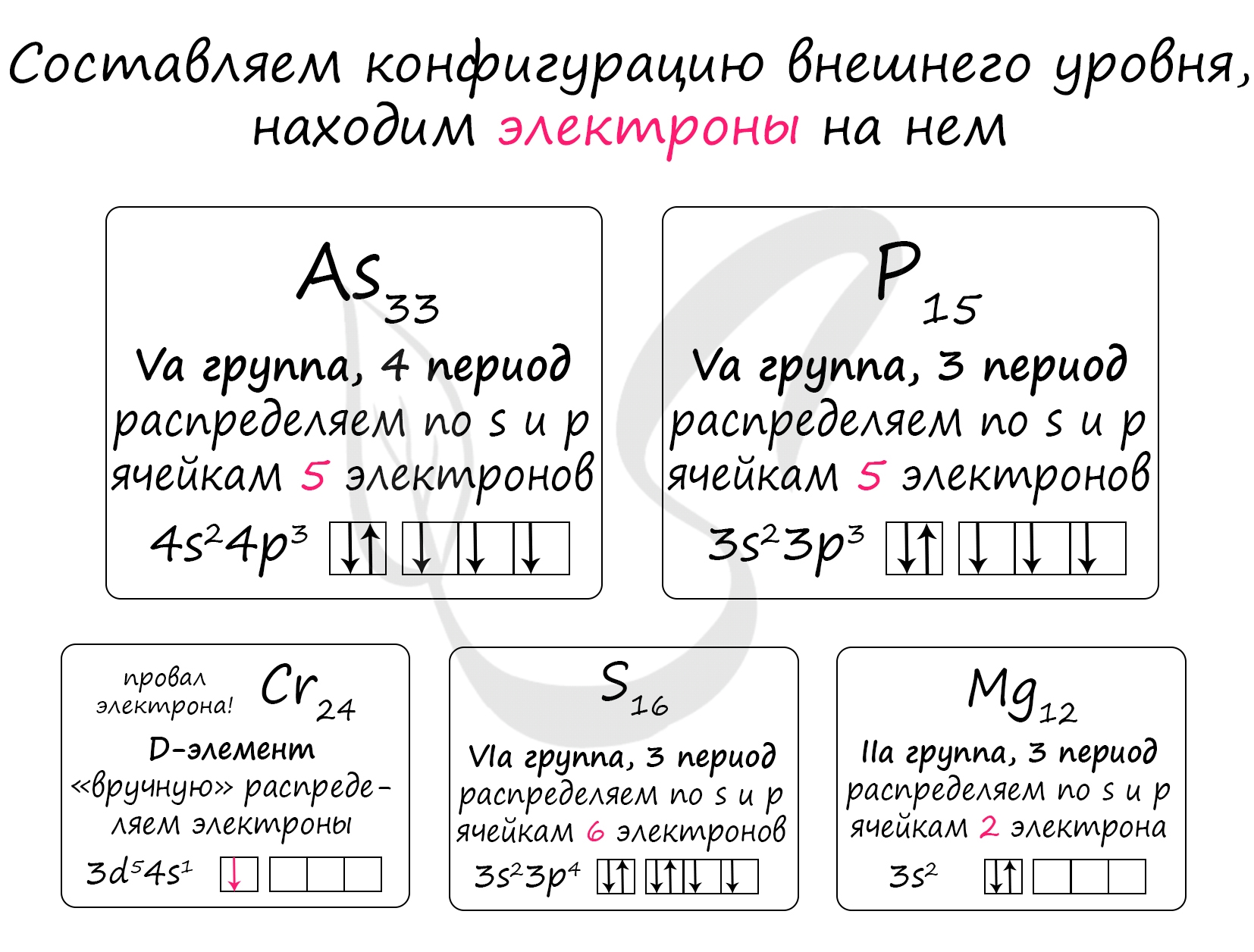
Проявляют низшую отрицательную степень окисления -3:
4) As - степени окисления -3 (арсениды - Ca3As2), +3 (As2O3), +5 (As2O5)
5) P - степени окисления -3 (PH3), +3 (P2O3), +5 (P2O5)
Остальные пункты:
1) Cr - металл - не проявляет отрицательных степеней окисления, степени окисления +2 (CrO), +3 (Cr2O3), +6 (H2CrO4)
2) S - степени окисления -2 (H2S), +4 (SO2), +6 (SO3)
3) Mg - металл - не проявляет отрицательных степеней окисления, постоянная степень окисления +2 (MgO)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7379.
Верный ответ: 14
Молекулярное строение имеют
1) C6H14 - ковалентные полярные связи (C-H) и ковалентные неполярные связи (C-C) → молекулярная кристаллическая решетка
4) HBr - ковалентные полярные связи → молекулярная кристаллическая решетка, между атомами неметаллов (H-Br) с разной электроотрицательностью → связь полярная
Остальные пункты:
2) Na2O - ионная связь → ионная кристаллическая решетка, ионная связь образуется между атомами с большой разницей в электроотрицательности (чаще всего: типичный металл + типичный неметалл)
3) KNO3 - между катионами K+ и анионом NO3- формируется ионная связь → ионная кристаллическая решетка, а внутри аниона NO3-, между N и O находятся ковалентные полярные связи
5) SiO2 - ковалентные полярные связи между атомами неметаллов (Si-O) → АТОМНАЯ кристаллическая решетка (многие соединения кремния являются исключениями и имеют именно атомную кристаллическую решетку)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7695.
Верный ответ: 248
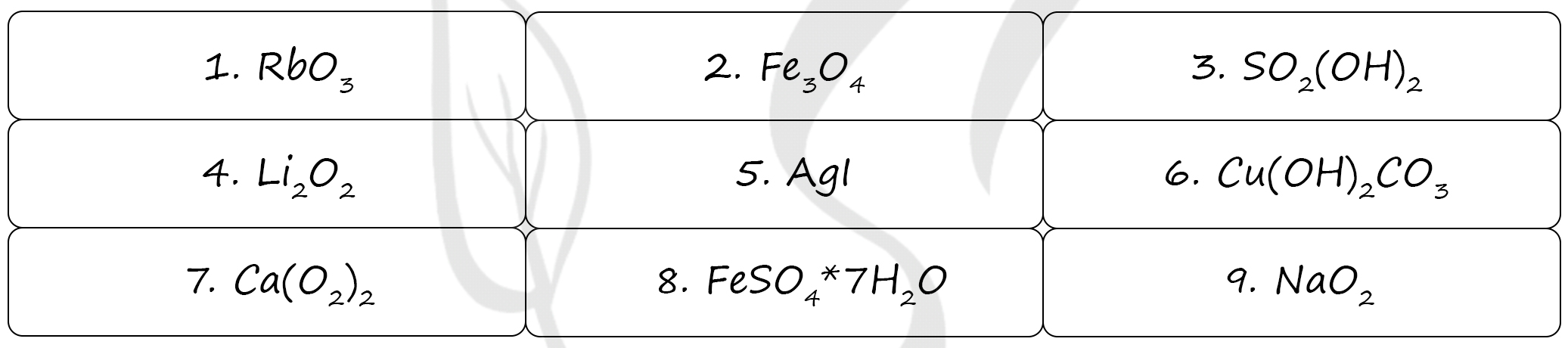
Под цифрами:
1 - озонид рубидия
2 - железная окалина: смесь двух оксидов - FeO (основный оксид) + Fe2O3 (амфотерный оксид)
3 - H2SO4 - серная кислота, записана максимально хитро :) в виде кислотного гидроксида SO2(OH)2, двухосновная сильная кислота
4 - пероксид лития (степень окисления лития +1, а кислорода -1)
5 - йодид серебра - средняя соль йодоводородной кислоты (HI)
6 - карбонат гидроксомеди (дигидроксокарбонат меди II), основная соль (наличие гидроксид-ионов)
7 - супероксид кальция, как и другие щелочноземельные металлы кальций образует супероксид Ca(O2)2
8 - кристаллогидрат (наличие молекул воды) сульфата железа
9 - супероксид натрия, промежуточное звено при окислении натрия кислородом
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7416.

1) серная кислота
2) гидроксид кальция
3) гидрокарбонат кальция
4) уксусная кислота
5) карбонат натрия
Верный ответ: 15
Гидрокарбонат кальция (3) нам не подходит, так как по условию мы видим карбонат-ионы, а не гидрокарбонат-ионы. Уксусная кислота (4) нам не подходит, так как она является слабым электролитом и её нельзя раскладывать на ионы.
Гидроксид кальция (2) мы не выбираем, так как по итогу реакции образуется осадок карбоната кальция, а у нас по условию задания нет осадков.
Вещество X - H2SO4 (1)
Вещество Y - Na2CO3 (5)
Na2CO3 + H2SO4 = Na2SO4 + CO2↑ + H2O
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7593.
Верный ответ: 4533
В этом задании скрыты 60 реакций! Правильный подход к его выполнению может значительно повысить ваш уровень знаний неорганической химии.
Итак, ключевой момент: нужно попробовать составить реакцию каждого из веществ (А, Б, В, Г) со всеми предложенными реагентами! Вы должны узнать, возможна ли каждая из этих реакций, или понять причину, по которой она невозможна (например, в реакции не может быть два осадка: и справа, и слева). Следуйте такому подходу, и вы удивитесь, как быстро повысится ваш "неорганический уровень" ;)
Реакции для O2 протекают так:
2Cu + O2 = 2CuO
3O2 + 2H2S = 2H2O + 2SO2
S + O2 = SO2
Реакции для P протекают так:
2P + 3Br2 = 2PBr3
3Mg + 2P = Mg3P2
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO
Реакции для Zn протекают так:
Zn + Cl2 = ZnCl2
Zn + 2H2O = Zn(OH)2 + H2
3Zn + Fe2O3 = 2Fe + 3ZnO
Реакции для Fe протекают так:
2Fe + 3Cl2 = 2FeCl3
3Fe + 4H2O = Fe3O4 + 4H2 (железо-паровой способ производства водорода)
Fe2O3 + Fe = 3FeO
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7839.
Верный ответ: 1342
А) В результате реакции обмена между хлоридом алюминия и гидроксидом калия → образуется гидроксид алюминия (нерастворим, осадок) и хлорид калия
AlCl3 + 3 KOH = Al(OH)3↓ + 3KCl
Б) Угольная кислота, хоть и слабая, но сильнее кремниевой кислоты и способна вытеснять кремниевую кислоту из её солей - из силикатов: угольная кислота зашифрована в виде воды и углекислого газа;
В результате реакции обмена образуется нерастворимая кремниевая кислота, которая выпадает в осадок, и карбонат калия
K2SiO3 + 2HCl = 2KCl + H2SiO3↓
В) Соляная кислота безусловно сильнее кремниевой: вытесняет её (реакция обмена) из силиката калия → образуется нерастворимая кремниевая кислота и хлорид калия
K2SiO3 + 2HCl = 2KCl + H2SiO3↓
Г) Подобные реакции идут по типу двойного гидролиза: гидролиз хлорида алюминия приводит к образованию гидроксида алюминия, а гидролиз карбоната калия приводит к образованию угольной кислоты, которая неустойчивая и распадается на воду (вода входит в состав гидроксида алюминия) и углекислый газ
Те ионы, которые не подвергаются гидролизу: хлориды и калий - объединяются в хлорид калия
3K2CO3 + 2AlCl3 + 3H2O = 2Al(OH)3↓ + 3CO2↑ + 6KCl
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7525.
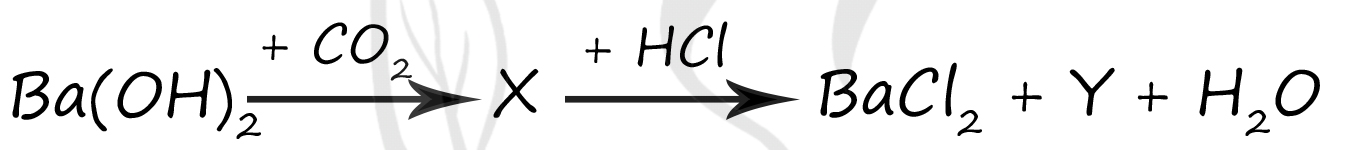
1) Ba(HCO3)2
2) CO
3) CH4
4) CO2
5) BaC2
Верный ответ: 14
Вещество X - (1) - Ba(HCO3)2
Углекислый газ в воде образует не стойкую угольную кислоту (CO2 + H2O ⇆ H2CO3), данная Угольная кислота вступает в реакцию с гидроксидом бария → образуя карбонаты (карбонат бария нерастворим) и гидрокарбонаты, в данном случае в списке представлен только гидрокарбонат, поэтому выбираем его
Ba(OH)2 + 2CO2 = Ba(HCO3)2
Вещество Y - (4) - CO2
В результате взаимодействия гидрокарбоната бария и соляной кислоты (реакция обмена, нет изменения степеней окисления) → образуется хлорид бария и неустойчивая угольная кислота, которая сразу же распадается на углекислый газ и воду
Ba(HCO3)2 + 2HCl = BaCl2 + 2CO2↑ + 2H2O
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7561.
Верный ответ: 1432
А) Вторичный спирт (изопропанол) - общая формула спиртов CnH2n+1OH - наличие гидроксильной группы, связанной с вторичным атомом углерода
Б) Орто-ксилол (1,2-диметилбензол) - ароматический углеводород (гомолог бензола), представляет собой бензольное кольцо, соединенное с двумя метильными группами
В) Аминокислоты (фенилаланин) - общая формула H2N-CH(R)-COOH - наличие и аминогруппы, и карбоксильной группы в одной молекуле
Г) Ароматические амины (анилин) - производные ароматических углеводородов, в которых один или несколько атомов водорода бензольного кольца замещены на аминогруппы (NH2)

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7212.
Верный ответ: 34
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7598.
Верный ответ: 5
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7914.
Верный ответ: 34
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7846.
Верный ответ: 6453
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7112.
Верный ответ: 1263
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7393.
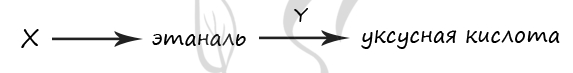
1) 1,2-дихлорэтан
2) KMnO4 (H+)
3) этан
4) 1,1-дихлорэтан
5) CuO (t°)
Верный ответ: 42
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7219.
Верный ответ: 12
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7010.
Верный ответ: 12
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7221.
Верный ответ: 242
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6942.
Верный ответ: 2122
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7363.
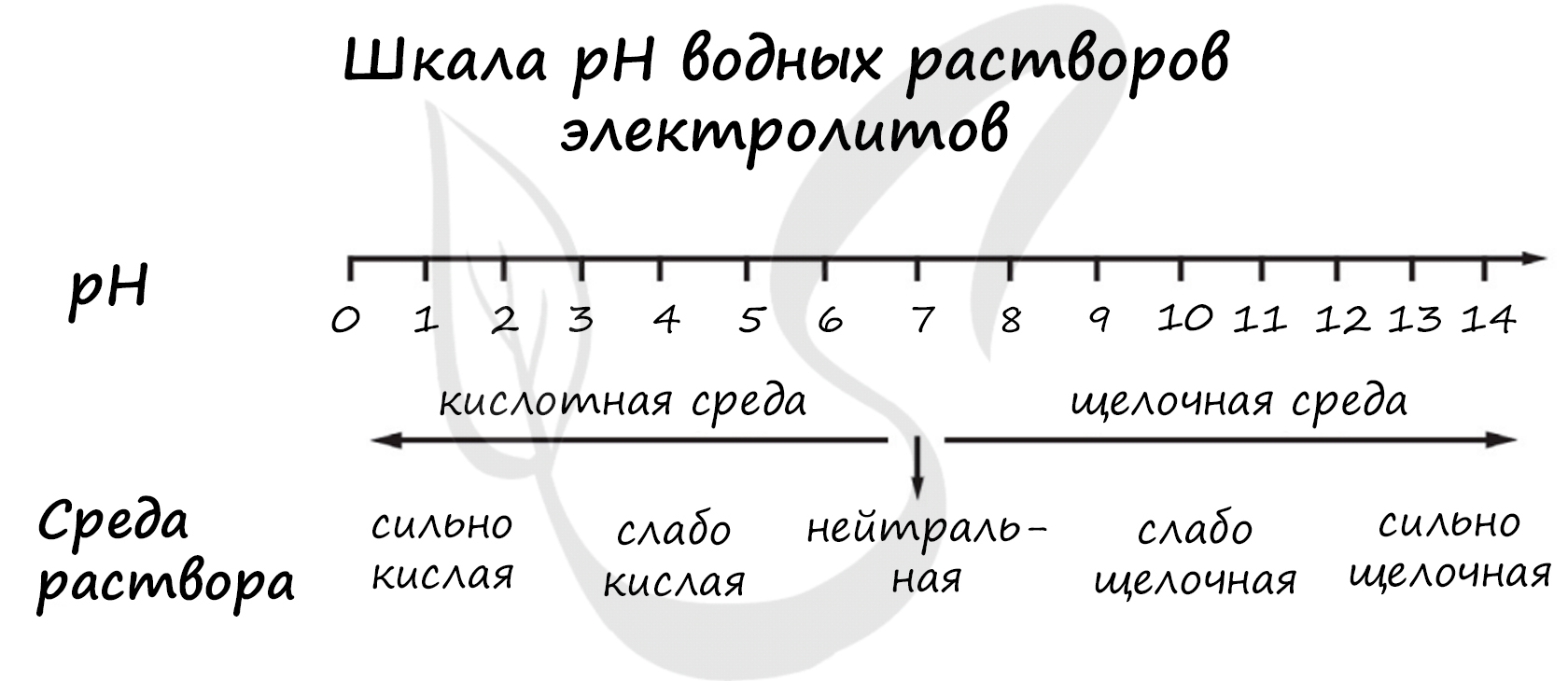
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») - водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.
1) Rb3PO4
2) NH4MnO4
3) HCl
4) Sr(OH)2
Верный ответ: 3214
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7014.
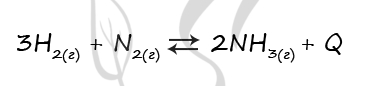
Верный ответ: 3221
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6875.
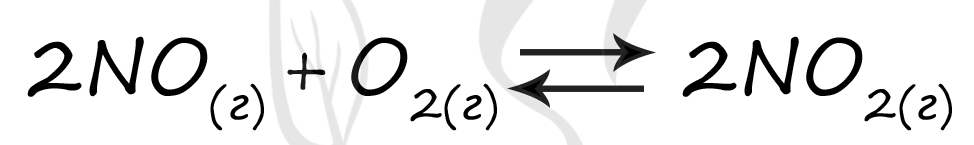
Верный ответ: 54
Таблица (по условиям задания)
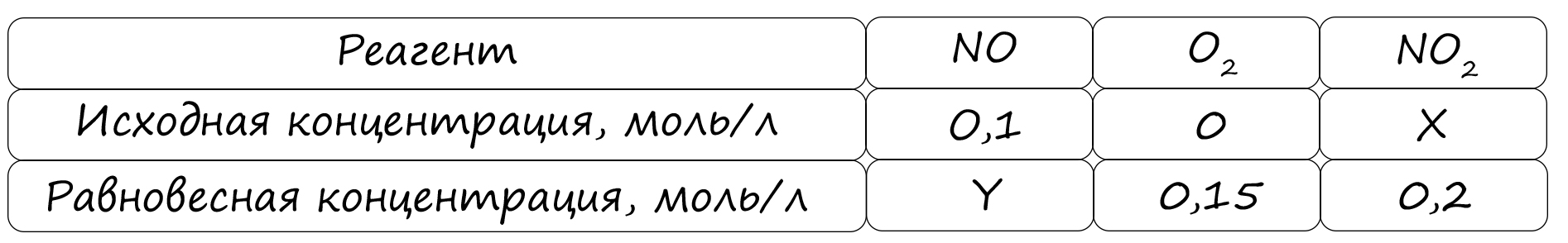
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6857.
Верный ответ: 1515
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7086.
Верный ответ: 241
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7717.
Ответом к заданиям 26-28 является число. Запишите это число в поле ответа в тексте работы, соблюдая при этом указанную степень точности. Единицы измерения физических величин указывать не нужно.
Верный ответ: 1800
Найдем массу соли, которая присутствует в исходном растворе:
m(соли) = 600 · 0.1 = 60 грамм

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7193.
Верный ответ: 400

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7894.
Верный ответ: 62,5
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
1) n(SO2) = v / Vr = 16,8 м3 / 22,4 м3/кмоль = 0,75 кмоль
2) n(FeS2) = 1/2 · n(SO2) = 1/2 · 0,75 = 0,375 кмоль
3) m(FeS2) = n · Mr = 0,375 кмоль · 120 кг/кмоль = 45 кг
4) w(FeS2) = 45 кг / 72 кг · 100% = 62,5%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7125.
Часть 2 Вы проверяете сами. Все пояснения и подсказки к частям 1 и 2 обязательно будут даны по окончании теста.
Для выполнения заданий 29,30 используйте следующий перечень веществ:
концентрированная азотная кислота, сероводород, нитрат хрома(III), нитрат цинка, фосфат натрия. Допустимо использование водных растворов веществ.
Возможна следующая реакция:
H2S + 8HNO3 = H2SO4 + 8NO2↑ + 4H2O

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7196.

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7197.
1) 2Cu + I2 = 2CuI
2) 2CuI + 4H2SO4 = (t°) 2CuSO4 + 2SO2↑ + I2 + 4H2O
3) CuSO4 + 2KOH = Cu(OH)2↓ + K2SO4
4) Cu(OH)2 = (t°) CuO + H2O
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7933.
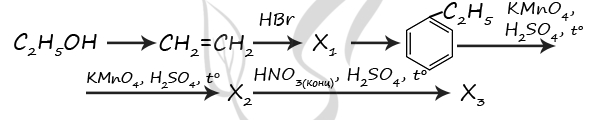
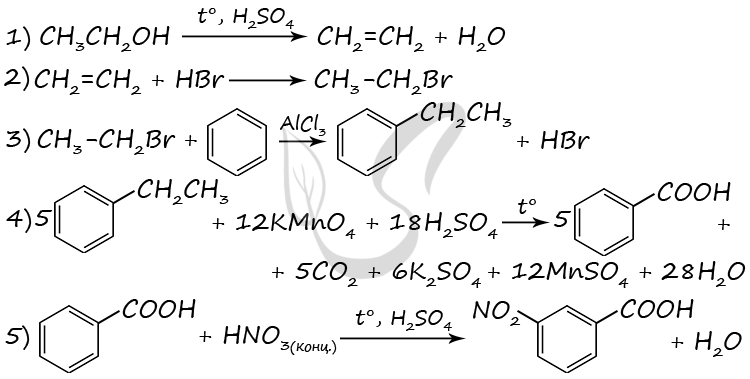
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7444.
1) Вычислим количество вещества продуктов
n(CO2) = 33,6 : 22,4 = 1,5 моль; n(C) = 1,5 моль
m(C) = 1,5 ⋅ 12 = 18 г
n(H2O) = 27/18 = 1,5 моль; n(H) = 2n(H2O) = 1,5 ⋅ 2 = 3 моль; m(H) = 3 ⋅ 1 = 3 г
m(O) = m(в-ва) - m(C) - m(H) = 21 - 18 - 3 = 0 г (кислород отсутствует)
Искомое вещество - углеводород - CxHy
Соотношение атомов n(C) : n(H) = x : y = 1,5 : 3 = 1 : 2
Простейшая формула - CH2
M(в-ва)прост. = 14 г/моль
M(в-ва)по условию = 1,875 ⋅ 22,4 = 42 г/моль
Молекулярная формула C3H6 - циклопропан или пропен. Только одно монохлорпроизводное, в котором атом хлора принадлежит к первичному атому углерода, образуется в результате присоединения хлороводорода к циклопропану (в результате реакции с пропеном получается 2-хлорпропан, атом хлора здесь принадлежит вторичному атому углероду, поэтому пропен нам не подходит)
2) Структурная формула


P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7901.
1) Уравнение реакции
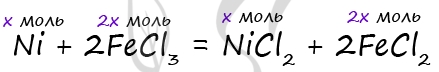
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7375.