


Для выполнения заданий 1-3 используйте следующий ряд химических элементов:
Ответом в заданиях 1-3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Верный ответ: 23
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7587.
Верный ответ: 451
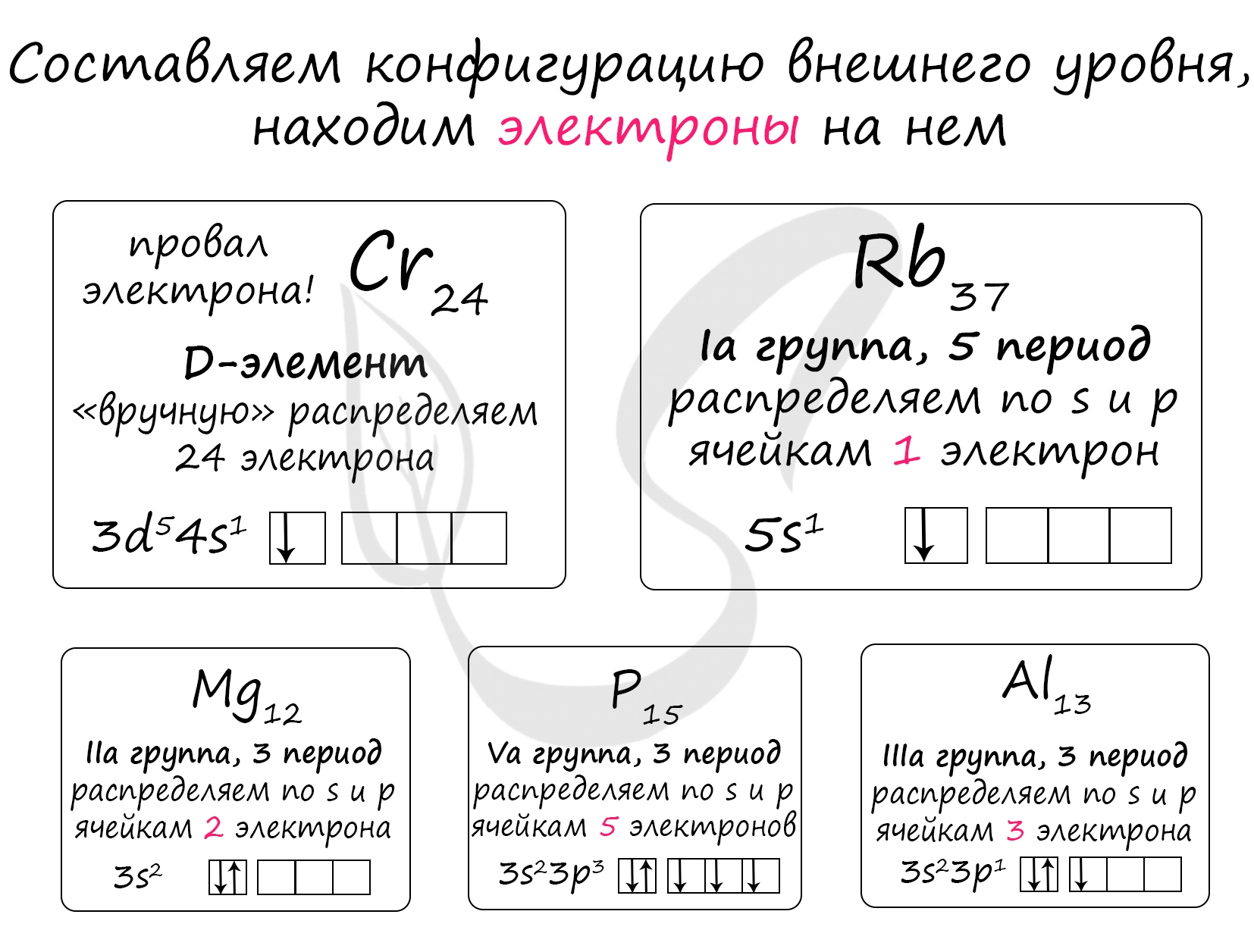
Выбранные элементы находятся в одном и том же периоде - 3. В периоде уменьшения числа валентных электронов (располагаются на внешнем уровне, способны к образованию связей с другими атомами) уменьшается справа налево (←), поскольку номер группы отражает число электронов на внешнем уровне (справедливо для элементов главных подгрупп)
Формула внешнего уровня:
P - Va группа 3 период, на внешнем уровне 5 электронов: 3s23p3
Al - IIIa группа 3 период, на внешнем уровне 3 электрона: 3s23p1
Mg - IIa группа 3 период, на внешнем уровне 2 электрона: 3s2
Число валентных электронов уменьшается в последовательности: P (4) → Al (5) → Mg (1)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7588.
Верный ответ: 24
Не характерна постоянная степень окисления для
2) Cr - степени окисления +2 (CrO), +3 (Cr2O3), +6 (H2CrO4)
4) P - степени окисления -3 (PH3), +3 (P2O3), +5 (P2O5)
Остальные пункты:
1) Mg - постоянная степень окисления +2 (MgO)
3) Rb - постоянная степень окисления +1 (Rb2O)
5) Al - постоянная степень окисления +3 (Al2O3)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7589.
Верный ответ: 45
Ионную кристаллическую решётку имеют
4) K2O - ионная связь → ионная кристаллическая решетка, ионная связь образуется между атомами с большой разницей в электроотрицательности (чаще всего: типичный металл + типичный неметалл)
5) CsCl - ионная связь → ионная кристаллическая решетка, ионная связь образуется между атомами с большой разницей в электроотрицательности (чаще всего: типичный металл + типичный неметалл)
Остальные пункты:
1) PCl3 - ковалентные полярные связи (P-Cl), между атомами неметаллов с разной электроотрицательностью → связь полярная
2) CO2 - ковалентные полярные связи (C-O)
3) Cl2 - ковалентная неполярная связь между атомами (Cl-Cl), атомы имеют одинаковую электроотрицательность → связь неполярная
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7835.
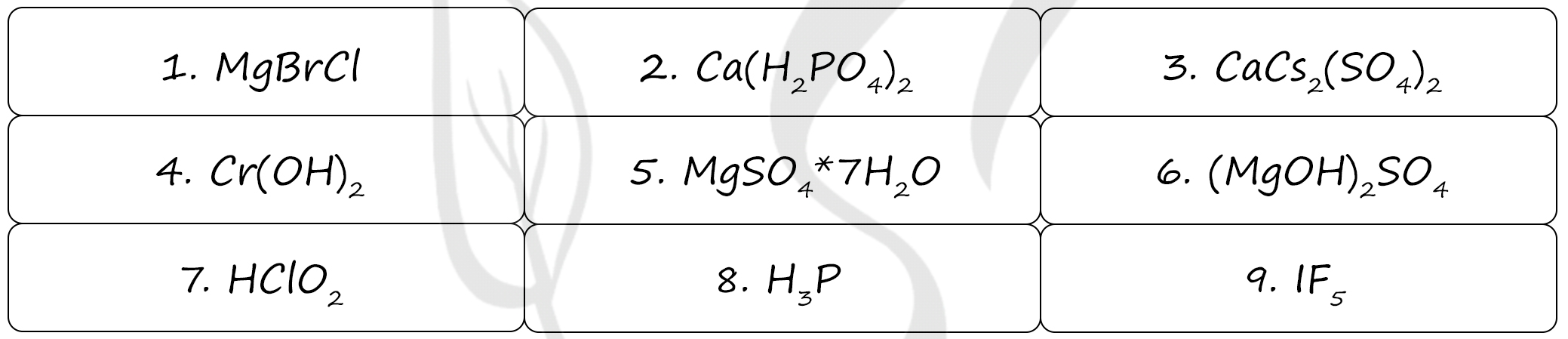
Верный ответ: 746
Под цифрами:
1 - бромид-хлорид магния - смешанная соль (два аниона)
2 - дигидрофосфат кальция, кислая соль слабой ортофосфорной кислоты (H3PO4), если бы был гидроортофосфат кальция - CaHPO4 (тоже кислая соль), если бы Ca3(PO4)2 - фосфат кальция (средняя соль - нет водорода в анионе)
3 - сульфат кальция-цезия - двойная соль (два катиона)
4 - гидроксид хрома (II) - проявляет основные свойства: реагирует с кислотами
5 - кристаллогидрат (наличие молекул воды) сульфата магния
6 - сульфат гидроксомагния (дигидроксосульфат магния II), основная соль (наличие гидроксид-ионов)
7 - хлористая кислота - слабая, является одноосновной кислотой, так в ее составе присутствует один атом водорода, который она может отдать в реакции с основанием
8 - фосфин (фосфид водорода, так как фосфор проявляет в фосфине степень окисления -3)
9 - пентафторид йода, является интергалогенидом (соединения галогенов между собой), фтор как более электроотрицательный элемент принимает степень окисления -1
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7451.

1) азотная кислота
2) гидроксид меди(II)
3) сульфид калия
4) угольная кислота
5) гидроксид калия
Верный ответ: 51
Не выбираем гидроксид меди (II) (2), так как по условию в исходных веществах у нас нет осадков (осадки не раскладываются на ионы). Не выбираем угольную кислоту (4), так как она является слабым электролитом и не раскладывается на ионы, а по условию в исходных веществах у нас нет угольной кислоты.
Не выбираем сульфид калия (3), так как по условию нам нужно выбрать гидроксид.
Вещество X - KOH (5)
Вещество Y - HNO3 (1)
В результате реакции обмена между гидроксидом калия и азотной кислотой → образуется нитрат калия и вода
KOH + HNO3 = KNO3 + H2O
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7838.
Верный ответ: 4312
В этом задании скрыты 60 реакций! Правильный подход к его выполнению может значительно повысить ваш уровень знаний неорганической химии.
Итак, ключевой момент: нужно попробовать составить реакцию каждого из веществ (А, Б, В, Г) со всеми предложенными реагентами! Вы должны узнать, возможна ли каждая из этих реакций, или понять причину, по которой она невозможна (например, в реакции не может быть два осадка: и справа, и слева). Следуйте такому подходу, и вы удивитесь, как быстро повысится ваш "неорганический уровень" ;)
Реакции для Pb(OH)2 протекают так:
Pb(OH)2 + 2NaOH = (t°) Na2PbO2 + 2H2O
Pb(OH)2 + 2HBr = PbBr2 + 2H2O
Pb(OH)2 + 2HCOOH = Pb(HCOO)2 + 2H2O
Реакции для S протекают так:
S + Cu = CuS
S + Cl2 = CuCl2
S + O2 = SO2
Реакции для CaI2 протекают так:
CaI2 + 2AgNO3 = Ca(NO3)2 + 2AgI
3CaI2 + 2K3PO4 = Ca3(PO4)2 + 6KI
CaI2 + Cl2 = CaCl2 + I2
Реакции для SO2 протекают так:
SO2 + H2O = H2SO3
SO2 + BaO = BaSO3
SO2 + 2NaOH = Na2SO3 + H2O
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7209.
Верный ответ: 1325
А) Сохраняем степени окисления магния (+2) и углерода (+4) → в результате реакции соединения получается карбонат магния
MgO + CO2 = MgCO3
Б) Лабораторный способ получения алкинов (чаще демонстрируется на примере карбида кальция) → образуется этин (ацетилен) и гидроксид магния
MgC2 + 2H2O = C2H2 + Mg(OH)2
В) Окисление магния до оксида магния
2Mg + CO2 = 2MgO + C
Г) В реакциях между средней солью и соответствующей кислотой → могут образовываться кислые соли
MgCO3 + H2O + CO2 = Mg(HCO3)2
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6895.

1) хлороводородная кислота
2) цинк и соляная кислота
3) азотная кислота
4) азотистая кислота
5) нитрит натрия
Верный ответ: 32
Вещество X - (3) - HNO3
Основания обожают реагировать с кислотами, данная реакция идёт по типичной схеме: основание + кислота = соль + вода (никто не меняет свои степени окисления, реакция обмена)
1) KOH + HNO3 = KNO3 + H2O
Вещество Y - (2) - Zn + HCl
Вторая реакция состоит из двух этапов:
Цинк вытесняет водород из соляной кислоты как более активный металл, стоящий в ряду напряжения до водорода
1) Zn + HCl = ZnCl2 + H2↑
Выделяющийся в первой реакции водород является хорошим восстановителем, который восстанавливает нитрат калия до нитрита
2) KNO3 + H2 = KNO2 + H2O
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7421.
Верный ответ: 1323
А) Простой эфир (диметиловый эфир) - общая формула CnH2n+2O - наличие связи R-O-R'
Б) Альдегиды (пропаналь) - общая формула CnH2nO - наличие карбонильной группы (С=O) у первичного атома углерода (альдегидная группа CHO)
В) Сложный эфир (метилформиат или метиловый эфир муравьиной кислоты) - общая формула СnH2nO2 - наличие двойной связи между углеродом и кислородом, наличие связи R-O-R'
Г) Альдегиды (метаналь) - общая формула CnH2nO - наличие карбонильной группы (С=O) у первичного атома углерода (альдегидная группа CHO)
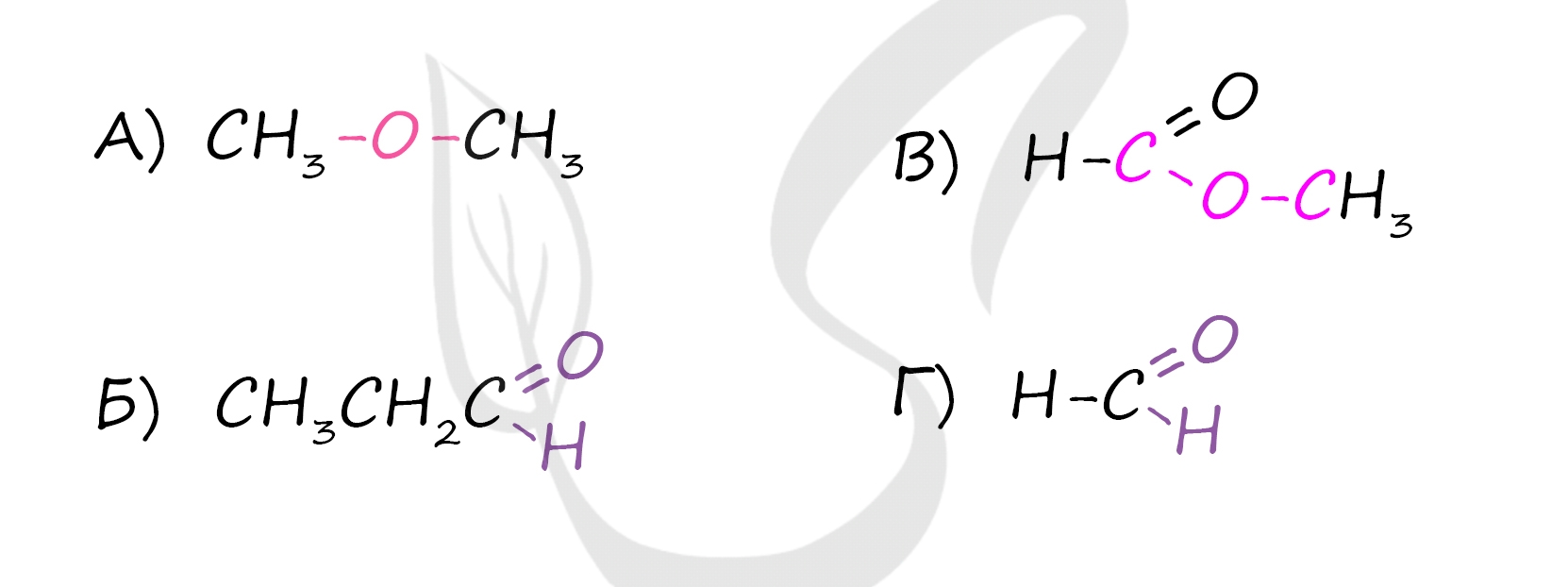
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7142.
Верный ответ: 15
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7353.
Верный ответ: 234
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6794.
Верный ответ: 34
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7076.
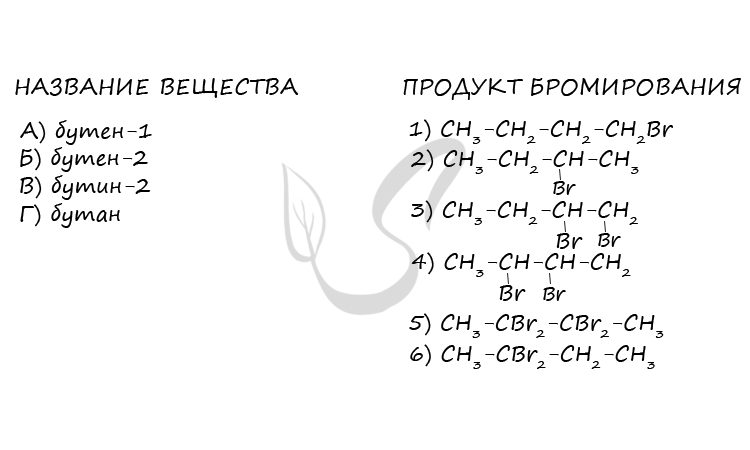
Верный ответ: 3452
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6762.
Верный ответ: 2164
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7603.
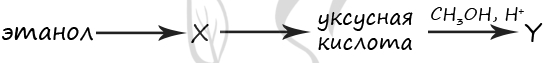
1) этан
2) этилформиат
3) этиламин
4) этаналь
5) метилацетат
Верный ответ: 45
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7569.
Верный ответ: 25
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7080.
Верный ответ: 35
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7606.
Верный ответ: 421
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7187.
Верный ответ: 5213
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7783.
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») - водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.
1) LiOH
2) MnBr3
3) MnBr2
4) CH3NH2
Верный ответ: 1432
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7539.
Верный ответ: 3443
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7015.
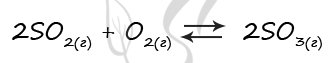
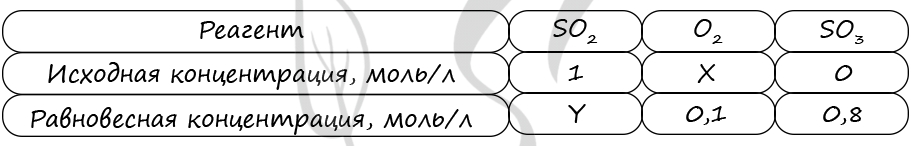
Верный ответ: 41
Таблица (по условиям задания)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7277.
Верный ответ: 1324
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6911.
Верный ответ: 4125
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7402.
Ответом к заданиям 26-28 является число. Запишите это число в поле ответа в тексте работы, соблюдая при этом указанную степень точности. Единицы измерения физических величин указывать не нужно.
Верный ответ: 50
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7718.
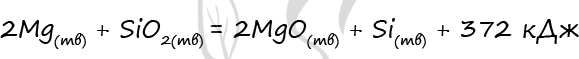
Верный ответ: 930
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7789.
Верный ответ: 37,5
SiO2 + 4HF = SiF4 + 2H2O
1) n(SiF4) = m / Mr = 20,8 кг / 104 кг/кмоль = 0,2 кмоль
2) n(SiO2) = n(SiF4) = 0,2 кмоль
3) m(SiO2) = n · Mr = 0,2 кмоль · 60 кг/кмоль = 12 кг
4) w(SiO2) = 12 кг / 32 кг · 100% = 37,5%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6985.
Часть 2 Вы проверяете сами. Все пояснения и подсказки к частям 1 и 2 обязательно будут даны по окончании теста.
Для выполнения заданий 29,30 используйте следующий перечень веществ:
магний, карбонат натрия, хлорат калия, гидроксид кальция, соляная кислота. Допустимо использование водных растворов веществ.
Возможна следующая реакция:
KClO3 + 3Mg + 6HCl = 3MgCl2 + KCl + 3H2O

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7546.

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7547.
1) BeCl2 + 2KOH = Be(OH)2↓ + 2KCl
2) Be(OH)2 + 2KOH = K2[Be(OH)4]
3) K2[Be(OH)4] + 2HCl = Be(OH)2↓ + 2KCl + 2H2O
4) Be(OH)2 + H2SO4 = BeSO4 + 2H2O
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7303.
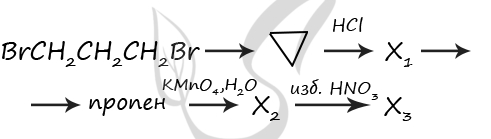
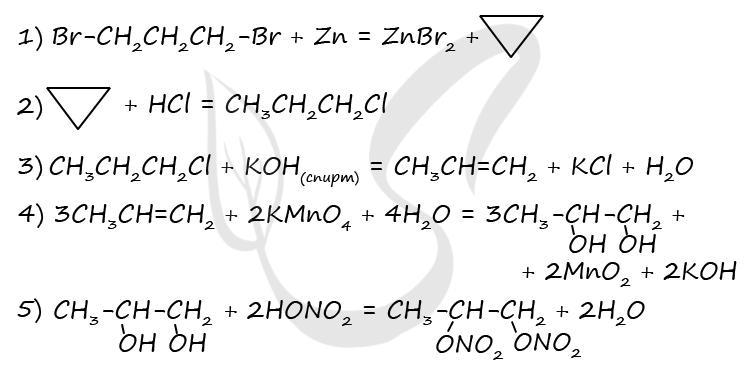
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7199.
1) Вещество - карбоновая кислота с общей формулой CnH2n+1COOH
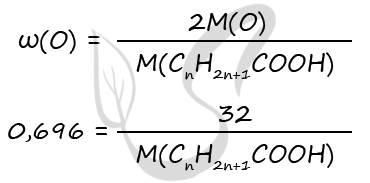

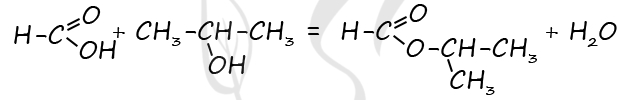
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7026.
1) Уравнения реакций
MgO + 2HCl = MgCl2 + H2O (1)
Mg3P2 + 6HCl = 3MgCl2 + 2PH3↑ (2)
MgCl2 + 2KF = MgF2↓ + 2KCl (3)
2) Найдем количество вещества соляной кислоты
m(HCl) = 365 ⋅ 0,34 = 124,1 г
n(HCl) = 124,1 : 36,5 = 3,4 моль
3) Примем количество вещества MgO как x, количество Mg3P2 - y, тогда
n1(HCl) = 2 ⋅ n(MgO) = 2x моль (по уравнению 1)
n2(HCl) = 6 ⋅ n(Mg3P2) = 6y моль (по уравнению 2)
Найденные значения составляют общее количество HCl:
2x + 6y = 3,4
x + 3y = 1,7
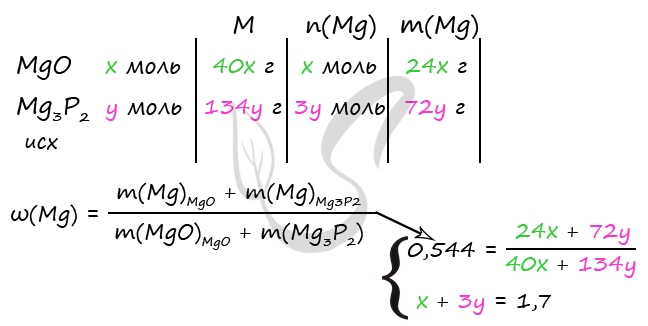
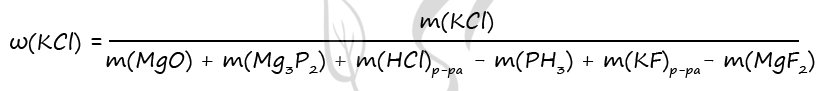
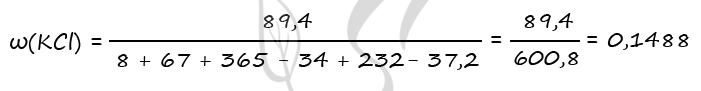
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7550.