


Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») - водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.
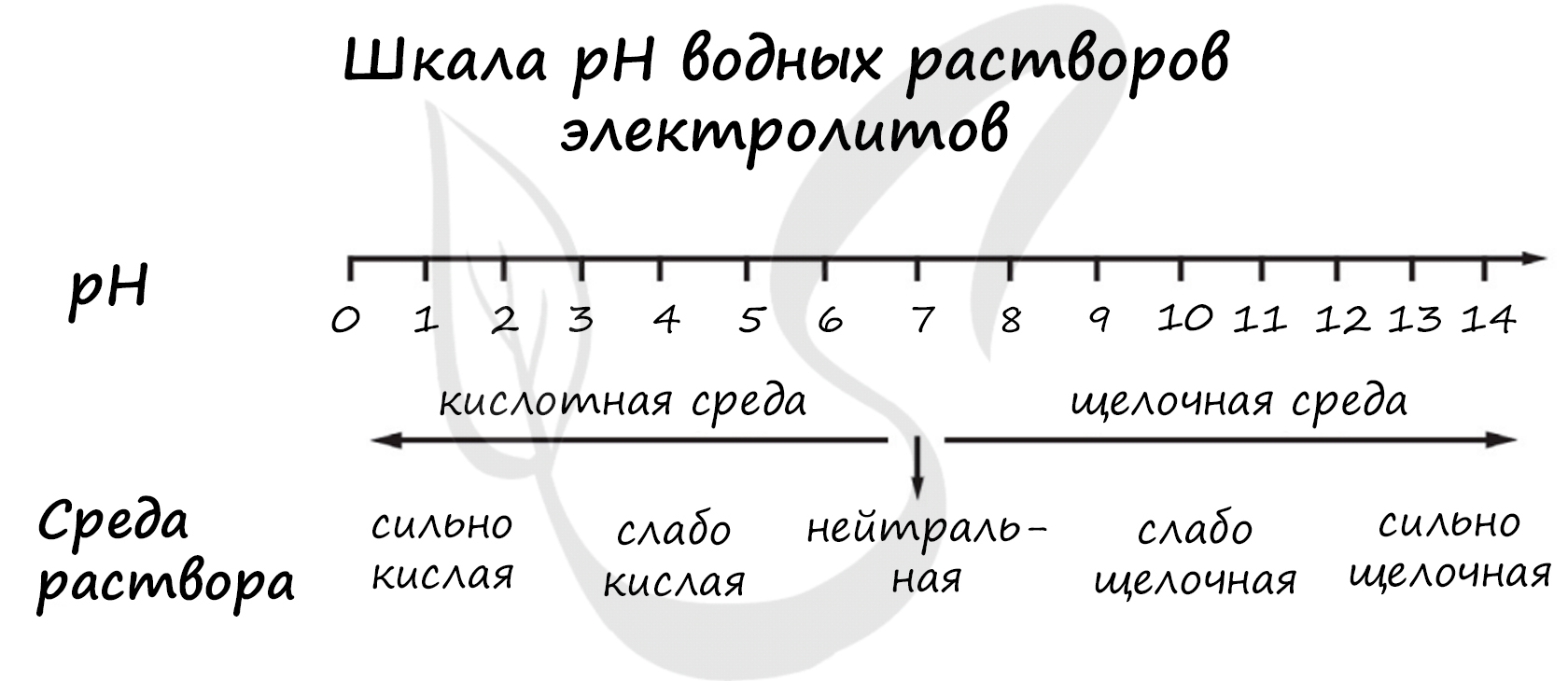
1) CsOH
2) (CH3COO)2Sr
3) HMnO4
4) MnSO4
Верный ответ: 3421
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6874.
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») - водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.

1) гидросульфид натрия
2) периодат калия
3) сульфид натрия
4) хлорид цинка
Верный ответ: 3124
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6839.
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») - водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.

1) Cr2(SO3)3
2) HBrO3
3) Li3PO4
4) HF
Верный ответ: 2413
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6804.
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») - водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.

1) Na2S
2) FeCl2
3) HClO3
4) Ca(OH)2
Верный ответ: 3214
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6769.