


1) Уравнения реакций:
4Al(NO3)3 = 2Al2O3 + 12NO2 + 3O2
Al2O3 + 2KOH + 3H2O = 2K[Al(OH)4]
Al(NO3)3 + 4KOH = K[Al(OH)4] + 3KNO3
2) Вычислим количество оксида алюминия:
n(газов) = 12,32 : 22,4 = 0,55 моль
n(O2) = 3/15 n(газов) = 0,11 моль
n(Al2O3) = 2/3 n(O2) = 0,0733 моль
3) Вычислим массу оставшегося нитрата алюминия 72 мл воды
(s = 71 г/100 г воды).
В 100 г воды - 71 г Al(NO3)3
В 72 г воды - x Al(NO3)3
x = 72 ⋅ 71 : 100 = 51,12 г
Возможно вычисление массу оставшегося нитрата алюминия через массовую долю:
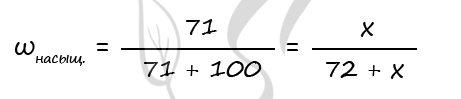
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6990.
1) Запишем уравнения реакций:
(1) Mg + 2HCl = MgCl2 + H2
(2) MgO + 2HCl = MgCl2 + H2O
(3) MgCl2(р-р) + 6H2O(ж) → MgCl2 · 6H2O↓ (выпадение в осадок КГ(кристаллогидрата), писать данную реакцию необязательно)
2) Вычислим количества исходных веществ:
n(H2) = V : Vm = 2,24 : 22,4 = 0,1 моль
n(Mg) = n(H2) = 0,1 моль
m(Mg) = n · M = 0,1 · 24 = 2,4 г
m(MgO) = 16 - 2,4 = 13,6 г
n(MgO) = m : M = 13,6 : 40 = 0,34 моль
3) Составим уравнение для вычисления количества кристаллогидрата:
n(HCl) = 2n(Mg) + 2n(MgO) = 0,88 моль
mр-ра(HCl) = n · M : ω = 0,88 · 36,5 : 0,25 = 128,48 г
mитог. р-ра = mр-ра(HCl) + m(смеси) - m(H2) = 128,48 + 16 - 0,1 · 2 = 144,28 г
n(MgCl2) = n(Mg) + n(MgO) = 0,44 моль
m(MgCl2) = n · M = 0,44 · 95 = 41,8 г
144,28 : 36,07 = 4 ⇒ в порции будет 41,8 : 4 = 10,45 г MgCl2
Масса порции после упаривания равна 36,07 - 7,8 = 28,27 г
Пусть в осадок выпало x моль КГ, тогда mв. КГ(MgCl2) = 95x, m(MgCl2 · 6H2O) = 203x
В 153 г раствора - 53 г соли
В (28,27 - 203x) г раствора - (10,45 - 95x) г соли
153 · (10,45 - 95x) = 53 · (28,27 - 203x)
x = 0,0266 моль
4) Вычислим массу КГ
m(MgCl2 · 6H2O) = 203x = 203 · 0,0266 = 5,3998 г
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6955.
1) Уравнения реакций
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
2NaOH + SO2 = Na2SO3 + H2O
2) Вычислим теоретическое количество газа
n(Cu) = m : M = 12,8 : 64 = 0,2 моль
nтеор.(SO2) = n(Cu) = 0,2 моль
3) Вычислим практическое количество газа
mнасыщ. р-ра = 83,16 - 1,26 = 81,9 г
В 130 г р-ра - 30 г соли
В 81,9 г р-ра - х г соли
х = 30 · 81,9 : 130 = 18,9 г
mобщ.(Na2SO3) = 18,9 + 1,26 = 20,16 г
n(Na2SO3) = m : M = 20,16 : 126 = 0,16 моль
nпракт.(SO2) = n(Na2SO3) = 0,16 моль
4) Вычислим выход
η = nпракт.(SO2) : nтеор.(SO2) · 100% = 0,16 : 0,2 · 100% = 80%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6920.
1) Уравнения реакций:
(1) 2Cu(NO3)2 = 2CuO + 4NO2 + O2
(2) CuO + 2HNO3 = Cu(NO3)2 + H2O
(3) Cu(NO3)2(р-р) + 6H2O(ж) → Cu(NO3)2 ⋅ 6H2O↓ - схема образования КГ
2) Определим состав твердой смеси
n(газов) = 39,2 : 22,4 = 1,75 моль
n(CuO) = 5/2 n(газов) = 0,7 моль
m(Cu(NO3)2)ост. = mтв. ост. - m(CuO) = 93,6 - 0,7 ⋅ 80 = 37,6 г
3) Составим уравнение для вычисления количества кристаллогидрата
n(HNO3) = 122,5 ⋅ 0,412 : 63 = 0,8 моль - в недостатке в реакции (2)
n(CuOпрореаг.) = n2(Cu(NO3)2) = 0,5n(HNO3) = 0,4 моль
m(Cu(NO3)2)в р-ре = 37,6 + 0,4 ⋅ 188 = 112,8 г
m(H2O) = m(H2O в р-ре HNO3) + m(H2O)по р. (2) = 122,5 ⋅ (1-0,412) + 0,4 ⋅ 18 = 79,23 г
Если в осадок выпало x моль кристаллогидрата, то на его образование необходимо x моль Cu(NO3)2 и 6x моль воды.
Растворимость 100 г на 100 г воды ⟹ в конечном растворе масса соли равна массе воды:
112,8 - 188x = 79,23 - 18 ⋅ 6x
4) Вычислим массу кристаллогидрата
Решим уравнение: x = 0,419 моль
m(Cu(NO3)2 ⋅ 6H2O) = 0,419 ⋅ (188 + 6 ⋅ 18) = 124 г
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6850.
1) Уравнения реакций:
CuO + H2SO4 = CuSO4 + H2O (1)
CuSO4 + Na2S = CuS + Na2SO4 (2)
H2SO4 + Na2S = H2S + Na2SO4 (3)
2) Вычислим количества веществ
n(CuO) = 12 : 80 = 0,15 моль
n(H2SO4) = 245 ⋅ 0,18 : 98 = 0,45 моль - в избытке
26 г соли - 126 г раствора
х г соли - 75,6 г раствора
m(Na2S) = 15,6 г
nобщ.(Na2S) = 15,6 : 78 = 0,2 моль
3) Вычислим массы веществ, содержащихся в итоговом растворе
n(CuSO4) = n(CuO) = 0,15 моль
n3(Na2S) = nобщ.(Na2S) - n2(Na2S) = 0,2 - 0,15 = 0,05 моль
n3(H2SO4) = n(H2SO4) - n1(H2SO4) = 0,45 - 0,15 = 0,3 моль - в изб. по сравнению с n3(Na2S)
nост.(H2SO4) = 0,3 - 0,05 = 0,25 моль
mост.(H2SO4) = 0,25 ⋅ 98 = 24,5 г
n(Na2SO4) = n2(Na2SO4) + n3(Na2SO4) = 0,15 + 0,05 = 0,2 моль
m(Na2SO4) = 0,2 ⋅ 142 = 28,4 г
4) Вычислим массовые доли веществ в растворе
m(р-ра) = m(CuO) + mр-ра(H2SO4) + mр-ра(Na2S) - m(CuS) - m(H2S) = 12 + 245 + 75,6 - 0,15 ⋅ 96 - 0,05 ⋅ 34 = 316,5 г
ω(Na2SO4) = 28,4 : 316,5 ⋅ 100% = 0,089 ⋅ 100% = 8,9%
ω(H2SO4) = 24,5 : 316,5 ⋅ 100% = 0,077 ⋅ 100% = 7,7%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6815.
1) Запишем реакцию
2AgNO3 + H2S = Ag2S↓ + 2HNO3
2) Определим массу раствора и массу растворенного нитрата серебра после охлаждения

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6780.