


1) Уравнения реакций
Na2O + CO2 = Na2CO3 (1)
2Na2O2 + 2CO2 = 2Na2CO3 + O2↑ (2)
3Na2CO3 + 2FeCl3 + 3H2O = 2Fe(OH)3↓ + 3CO2↑ + 6NaCl (3)
2) Вычислим количество карбоната натрия в конечном растворе
m(Na2CO3)непрореаг. = 0,04 ⋅ 795 = 31,8 г
n(Na2CO3)непрореаг. = 31,8 : 106 = 0,3 моль
3) Запишем формулу конечного раствора
m(конеч р-ра) = m(исх р-ра) + m(FeCl3)р-ра - m(Fe(OH)3) - m(CO2)
Пусть n(Na2CO3)прореаг. = x моль, тогда по 3 уравнению n(Fe(OH)3) = 0,667x моль, n(CO2) = x моль. Тогда
m(Fe(OH)3) = 0,667x моль ⋅ 107 г/моль = 71,369x (г)
n(CO2) = n(Na2CO3) = x моль
m(CO2) = 44 г/моль ⋅ x = 44x (г)
4) Подставим в формулу конечного раствора вычисленные в п. 3 значения и найдем n(Na2CO3)прореаг.
795 = 600 + 229,6 - 71,369x - 44x
В результате вычислений x = 0,3 моль = n(Na2CO3)прореаг.
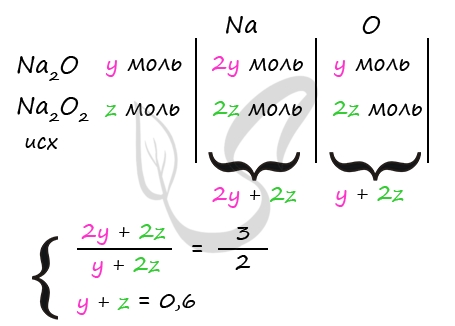
5) Вычислим состав исходной смеси
n(Na2CO3)общ. = n(Na2CO3)непрореаг. + n(Na2CO3)прореаг. = 0,3 + 0,3 = 0,6 моль
Пусть n(Na2O) = y моль, n(Na2O2) = z моль, тогда
y + z = 0,6 моль
n(Na2O) = n1(Na2CO3) = y моль (по уравнению 1)
n(Na2O2) = n2(Na2CO3) = z моль (по уравнению 2)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7585.
1) Уравнения реакций
MgO + 2HCl = MgCl2 + H2O (1)
Mg3P2 + 6HCl = 3MgCl2 + 2PH3↑ (2)
MgCl2 + 2KF = MgF2↓ + 2KCl (3)
2) Найдем количество вещества соляной кислоты
m(HCl) = 365 ⋅ 0,34 = 124,1 г
n(HCl) = 124,1 : 36,5 = 3,4 моль
3) Примем количество вещества MgO как x, количество Mg3P2 - y, тогда
n1(HCl) = 2 ⋅ n(MgO) = 2x моль (по уравнению 1)
n2(HCl) = 6 ⋅ n(Mg3P2) = 6y моль (по уравнению 2)
Найденные значения составляют общее количество HCl:
2x + 6y = 3,4
x + 3y = 1,7
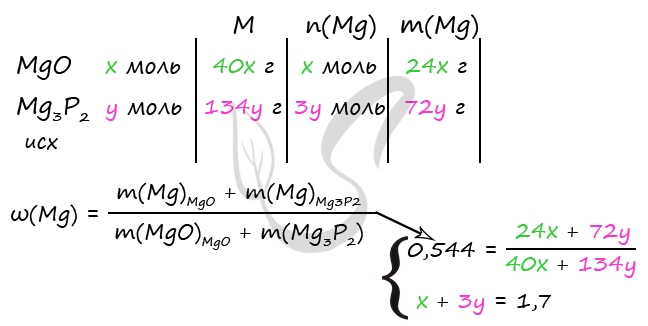
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7550.
1) Уравнения реакций
2FeCl2 + Cl2 = 2FeCl3 (1)
FeCl3 + Cl2 = (не идет)
FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl (2)
2) Вычислим массу гидроксида натрия
m(NaCl) = 526,5 ⋅ 0,2 = 105,3 г
n(NaCl) = 105,3 : 58,5 = 1,8 моль
n(NaOH) = n(NaCl) = 1,8 моль (по уравнению 2)
m(NaOH) = 1,8 ⋅ 40 = 72 г
3) Так как нам известна формула конечного раствора
m(кон. р-ра) = m(FeCl3*FeCl2)р-ра + m(Cl2)прореаг. + m(NaOH)р-ра - m(Fe(OH)3)
Изменим данную формулу:
m(NaOH)р-ра = m(кон. р-ра) - m(FeCl3*FeCl2)р-ра - m(Cl2)прореаг. + m(Fe(OH)3)
4) Найдем FeCl3общего по уравнению (3)
n(FeCl3)общ = 1/3 ⋅ n(NaCl) = 1/3 ⋅ 1,8 = 0,6 моль
Допустим, было x моль FeCl2 и y моль FeCl3исх., в таком случае n(FeCl3)обр. = n(FeCl2)исх. = x моль (это следует из уравнения 1), следовательно
n(FeCl3)обр + n(FeCl3)исх = n(FeCl3)общ
0,6 = x + y
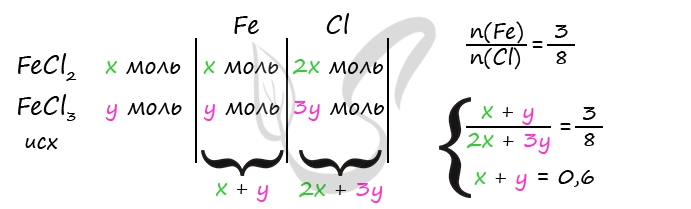
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7515.
1) Уравнения реакций:
2KCl + 2H2O = 2KOH + H2 + Cl2 (1)
2H2O = 2H2 + O2 (2)
4KOH + P2O5 = 2K2HPO4 + H2O (3)
2) Вычислим количества исходных веществ
m(KCl) = mр-ра · ω(KCl) = 80 · 0,25 = 20 г
n(KCl) = m : M = 20 : 74,5 = 0,268 моль
nобщ.(H2) = V : Vm = 8,96 : 22,4 = 0,4 моль
n(P2O5) = m : M = 9,514 : 142 = 0,067 моль
3) Вычислим количества соли калия и веществ, образовавшихся при электролизе
Если весь KCl вступит в реакцию (1), то выделится 0,134 моль водорода < 0,4 моль ⇒ начнется электролиз воды
n(KOH) = n(KCl) = 0,268 моль
n1(H2) = n1(Cl2) = 0,5n(KOH) = 0,134 моль
n2(H2) = nобщ.(H2) - n1(H2) = 0,4 - 0,134 = 0,266 моль
n(O2) = 0,5n2(H2) = 0,133 моль
n(KOH) : n(P2O5) = 0,268 : 0,067 = 4 : 1 ⇒ образуется гидрофосфат калия (коэфф.4 и 1)
n(K2HPO4) = 0,5n(KOH) = 0,134 моль
4) Вычислим массу выпавшего осадка
m(K2HPO4) = n · M = 0,134 · 174 = 23,316 г
mр-ра = mр-ра(KCl) - m(H2) - m(Cl2) - m(O2) + m(P2O5) = 80 - 2 · 0,4 - 71 · 0,134 - 0,133 · 32 + 9,514 = 74,94 г
m(H2O) = mр-ра - m(K2HPO4) = 74,94 - 23,316 = 51,624 г
В 100 г воды - 25 г соли
В 51,624 г воды - x г соли
x = 12,9 г = mраств.(K2HPO4)
m↓(K2HPO4) = m(K2HPO4) - mраств. = 23,316 - 12,9 = 10,416 г
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6885.