


1) Уравнения реакций
Na2O + CO2 = Na2CO3 (1)
2Na2O2 + 2CO2 = 2Na2CO3 + O2↑ (2)
3Na2CO3 + 2FeCl3 + 3H2O = 2Fe(OH)3↓ + 3CO2↑ + 6NaCl (3)
2) Вычислим количество карбоната натрия в конечном растворе
m(Na2CO3)непрореаг. = 0,04 ⋅ 795 = 31,8 г
n(Na2CO3)непрореаг. = 31,8 : 106 = 0,3 моль
3) Запишем формулу конечного раствора
m(конеч р-ра) = m(исх р-ра) + m(FeCl3)р-ра - m(Fe(OH)3) - m(CO2)
Пусть n(Na2CO3)прореаг. = x моль, тогда по 3 уравнению n(Fe(OH)3) = 0,667x моль, n(CO2) = x моль. Тогда
m(Fe(OH)3) = 0,667x моль ⋅ 107 г/моль = 71,369x (г)
n(CO2) = n(Na2CO3) = x моль
m(CO2) = 44 г/моль ⋅ x = 44x (г)
4) Подставим в формулу конечного раствора вычисленные в п. 3 значения и найдем n(Na2CO3)прореаг.
795 = 600 + 229,6 - 71,369x - 44x
В результате вычислений x = 0,3 моль = n(Na2CO3)прореаг.
5) Вычислим состав исходной смеси
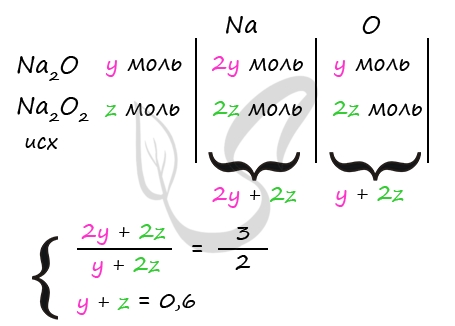
n(Na2CO3)общ. = n(Na2CO3)непрореаг. + n(Na2CO3)прореаг. = 0,3 + 0,3 = 0,6 моль
Пусть n(Na2O) = y моль, n(Na2O2) = z моль, тогда
y + z = 0,6 моль
n(Na2O) = n1(Na2CO3) = y моль (по уравнению 1)
n(Na2O2) = n2(Na2CO3) = z моль (по уравнению 2)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7585.
1) Уравнения реакций
MgO + 2HCl = MgCl2 + H2O (1)
Mg3P2 + 6HCl = 3MgCl2 + 2PH3↑ (2)
MgCl2 + 2KF = MgF2↓ + 2KCl (3)
2) Найдем количество вещества соляной кислоты
m(HCl) = 365 ⋅ 0,34 = 124,1 г
n(HCl) = 124,1 : 36,5 = 3,4 моль
3) Примем количество вещества MgO как x, количество Mg3P2 - y, тогда
n1(HCl) = 2 ⋅ n(MgO) = 2x моль (по уравнению 1)
n2(HCl) = 6 ⋅ n(Mg3P2) = 6y моль (по уравнению 2)
Найденные значения составляют общее количество HCl:
2x + 6y = 3,4
x + 3y = 1,7
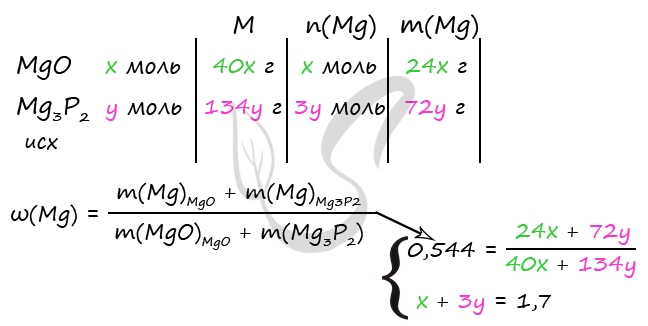
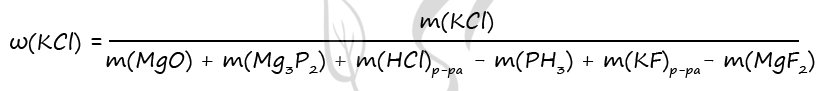
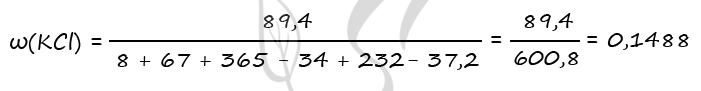
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7550.
1) Уравнения реакций
2FeCl2 + Cl2 = 2FeCl3 (1)
FeCl3 + Cl2 = (не идет)
FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl (2)
2) Вычислим массу гидроксида натрия
m(NaCl) = 526,5 ⋅ 0,2 = 105,3 г
n(NaCl) = 105,3 : 58,5 = 1,8 моль
n(NaOH) = n(NaCl) = 1,8 моль (по уравнению 2)
m(NaOH) = 1,8 ⋅ 40 = 72 г
3) Так как нам известна формула конечного раствора
m(кон. р-ра) = m(FeCl3*FeCl2)р-ра + m(Cl2)прореаг. + m(NaOH)р-ра - m(Fe(OH)3)
Изменим данную формулу:
m(NaOH)р-ра = m(кон. р-ра) - m(FeCl3*FeCl2)р-ра - m(Cl2)прореаг. + m(Fe(OH)3)
4) Найдем FeCl3общего по уравнению (3)
n(FeCl3)общ = 1/3 ⋅ n(NaCl) = 1/3 ⋅ 1,8 = 0,6 моль
Допустим, было x моль FeCl2 и y моль FeCl3исх., в таком случае n(FeCl3)обр. = n(FeCl2)исх. = x моль (это следует из уравнения 1), следовательно
n(FeCl3)обр + n(FeCl3)исх = n(FeCl3)общ
0,6 = x + y
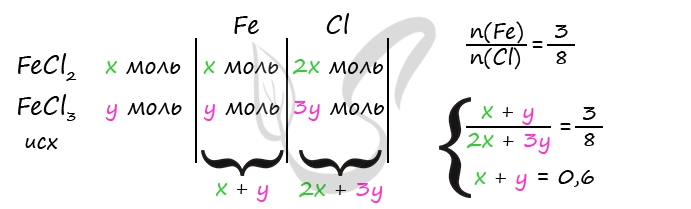
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7515.
1) Исходя из того, что количество выделенного металла (Me) одинаково на обеих пластинках, сделаем вывод о том, что количества железа и кадмия, участвующих в реакциях, равны:
М(Сl2) + Fe = Мe + FeСl2 (1)
М(Сl2) + Cd = Мe + CdСl2 (2)
2)Пусть x - молярная масса неизвестного металла: x = M(Me). Тогда
n(Fe) = Δm1/ΔM1 = 2/(x - 56)
n(Cd) = Δm2/ΔM2 = 12/(112 - x)
3)Поскольку n(Fe) = n(Cd), запишем:
2/(x - 56) = 12/(112 - x)
Отсюда 0,7x = 44,8
x = 64 г/моль
Искомый металл - медь, так как M(Cu) = 64 г/моль
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7480.
1) Уравнение реакции
СuSO4 + Fe = FeSO4 + Cu
2) Рассчитаем массу сульфата меди(II) в исходном растворе
n(СuSO4) = n(Сu) = n(Fe)
Чтобы найти эти количества вещества, рассчитаем массу СuSO4 в исходном растворе:
m(СuSO4)исх = 0,3 • 1,175 • 63,5 = 22,4 г.
3) После реакции количество вещества (по условию задачи), а следовательно, и масса CuSO4 уменьшились вдвое. Отсюда m(СuSO4)ост. = 11,2 г.
4) Вычислим количество вещества сульфата меди(II), израсходованного в реакции, изменение массы пластинки
n(СuSO4) = m/М = 11,2/160 = 0,07 моль.
Изменение массы пластинки составляет:
m(Сu) - m(Fe) = n•(M(Cu) - M(Fe)) = 0,07 • 8 = 0,56 г.
4) Вычислим массу пластинки после реакции: 7 + 0,56 = 7,56 г.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7445.
I способ решения
1) Пусть М(М) = m(М) = x г, а масса пластинки – у г. Тогда можно составить систему уравнений:
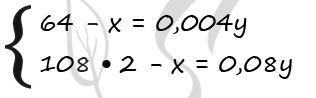
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7410.
1) Уравнение реакции
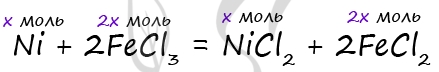
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7375.
1) Уравнение реакции
Zn + СdSO4 = ZnSO4 + Сd
2) Вычислим разницу изначальной и конечной массы пластинки
Δm = 0,094 • 60 = 5,64 г.
3) Обозначим через x количество вещества каждого из компонентов, вступивших в реакцию. В таком случае
Δm = M(Cd) • x - M(Zn) • x = 112x - 65x = 5,64 г
x = 0,12 моль
4) Вычислим массу кадмия, выделившегося на пластинке
m(Cd) = M(Cd) • 0,12 = 112 • 0,12 = 13,44 г.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7340.
1) Уравнение реакции
СuSO4 + Fe = FeSO4 + Сu
2) Если бы она произошла строго в соответствии с уравнением, растворение 1 моль железа пластинки привело бы к выделению на ней 1 моль меди, а изменение массы пластинки составило бы 8 г (64 - 56 = 8).
Так как в соответствии с условием масса пластинки изменилась только на 0,8 г, можно вычислить и количество, и массу меди, появившейся на пластинке: 0,8 : 8 = 0,1 моль меди или 0,1 ⋅ 64 = 6,4 г меди.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7305.
1) Уравнения реакций
Na2S + 2H2O = 2NaOH + H2 + S
4NaOH + ZnSO4 = Na2[Zn(OH)4] + Na2SO4
2) Рассчитаем количество вещества гидроксида натрия и сульфата цинка
m(Na2S) = 100 ⋅ 0,078 = 7,8 г
n(Na2S) = 7,8 : 78 = 0,1 моль
n(NaOH) = 2n(Na2S) = 0,2 моль
n(ZnSO4) = n(ZnSO4⋅7H2O) = 5,74 : 287 = 0,02 моль
3) Очевидно, что гидроксид натрия в большом избытке, поэтому вторая реакция протекает с образованием комплексной соли. Максимальная масса осадка выпадет при нейтрализации остатка гидроксида натрия и частичном разрушении комплекса:
NaOH + HCl = NaCl + H2O
Na2[Zn(OH)4] + 2HCl = 2NaCl + Zn(OH)2 + 2H2O
n(NaOHост.) = 0,2 - 0,02 ⋅ 4 = 0,12 моль
n(Na2[Zn(OH)4]) = n(ZnSO4) = 0,02 моль
4) Вычислим массу 20%-го раствора соляной кислоты
n(HCl) = 2n(Na2[Zn(OH)4]) + n(NaOHост.) = 0,04 + 0,12 = 0,16 моль
m(HCl) = 0,16 ⋅ 36,5 = 5,84 г
mр-ра(HCl) = 5,84 : 0,2 = 29,2 г
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7270.