


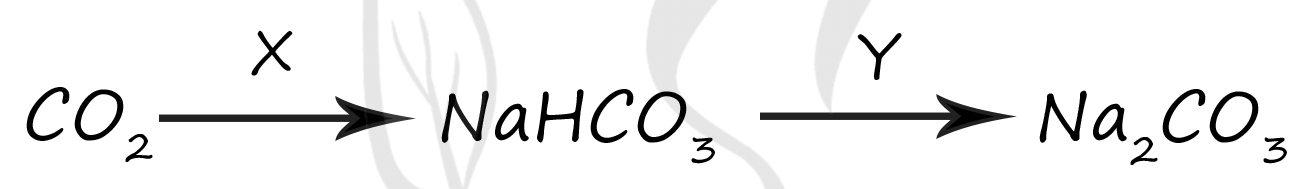
1) H2
2) Na2CO3(р-р)
3) NaCl(р-р)
4) NaOH(изб)
5) CO2(р-р)
Верный ответ: 24
Вещество X - (2) - Na2CO3(р-р)
В условиях раствора углекислый газ образует нестойкую угольную кислоту, которая прореагирует с карбонатом натрия: при реакции средних солей с соответствующими кислотами → образуются кислые соли
Na2CO3 + H2O + CO2 = 2NaHCO3
Вещество Y - (4) - NaOH(изб)
Чтобы превратить кислую соль в среднюю, следует добавить соответствующее основание
NaHCO3 + NaOH = Na2CO3 + H2O
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7211.
Верный ответ: 21
Вещество X - (2) - NaBrO3
В реакции брома с гидроксидом натрия → получается именно бромат натрия (делаем вывод, что это реакция шла в горячем растворе, потому что в прохладных условиях был бы гипобромит натрия)
3Br2 + 6NaOH = (t°) 5NaBr + NaBrO3 + 3H2O
Промежуточной реакцией является разложение бромата натрия на бромид натрия и кислород
2NaBrO3 = (t°) 2NaBr + 3O2
Вещество Y - (1) - NaNO2
При окислении нитрита натрия кислородом → образуется нитрат натрия
2NaNO2 + O2 = 2NaNO3
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7176.
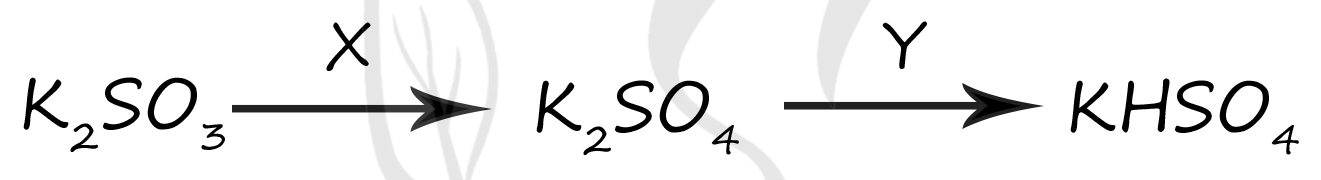
1) H2SO4
2) NaNO3(р-р)
3) SO2
4) NaOH
5) H2O2
Верный ответ: 51
Вещество X - (5) - H2O2
Чтобы получить из сульфита → сульфат, следует взять какой-нибудь окислитель - например пероксид водорода
K2SO3 + H2O2 = K2SO4 + H2O
Вещество Y - (1) - H2SO4
Чтобы получить из средней соли → кислую - следует добавить к средней соли соответствующую кислоту
K2SO4 + H2SO4 = 2KHSO4
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7141.

1) Br2(р-р)
2) NaNO3(р-р)
3) SO2
4) NaOH
5) H2S
Верный ответ: 14
Вещество X - (1) - Br2(р-р)
Для окисления сернистой кислоты до серной нужен сильный окислитель, подойдёт бром (1)
H2SO3 + Br2 = H2SO4 + HBr
Cероводород (5) напротив является хорошим восстановителем, поэтому его выбирать не нужно
Вещество Y - (4) - NaOH
В реакциях оснований с многоосновными кислотами (в избытке) образуются кислые соли
NaOH + H2SO4 = NaHSO4 + H2O
Если бы в избытке было основание, то мы могли бы получить среднюю соль
2NaOH + H2SO4 = Na2SO4 + 2H2O
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7106.
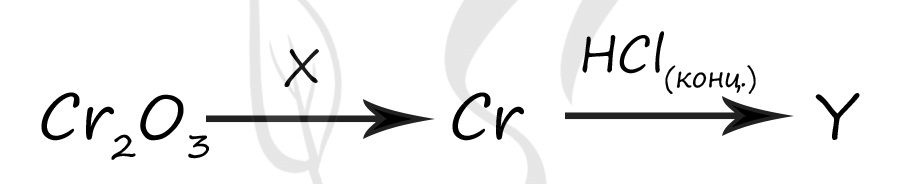
1) CrCl3
2) CrCl2
3) H2
4) Cu
5) H2CrO4
Верный ответ: 31
Вещество X - (3) - H2
Для восстановления хрома из оксида хрома (III) следует взять какой-нибудь хороший восстановитель - например водород
Cr2O3 + 3H2 = 2Cr + 3H2O
Вещество Y - (1) - CrCl3
В реакции с соляной кислотой хром будет окислен до наиболее устойчивой степени окисления +3
2Cr + 6HCl = 2CrCl3 + 3H2
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7071.

1) Br2(р-р)
2) HNO3(конц.)
3) SO2
4) NaOH
5) HCl
Верный ответ: 12
Вещество X - (1) - Br2(р-р)
Бром вытесняет серу, поскольку бром более активный неметалл, чем сера
Na2S + Br2 = 2NaBr + S
Вещество Y - (2) - HNO3(конц.)
Азотная кислота - сильный окислитель: сера будет окислена до серной кислоты, а побочным газообразным продуктом будет оксид азота (IV), поскольку азотная кислота была концентрированная
S + 6HNO3 = H2SO4 + 6NO2 + 2H2O
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7036.
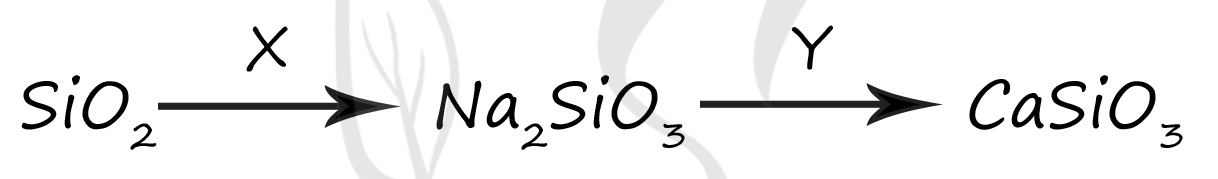
1) NaCl
2) BaSO4
3) Ca
4) CaCl2
5) Na2CO3
Верный ответ: 54
Вещество X - (5) - Na2CO3
Оксид кремния (IV) отличается уникальными свойствами: он способен к (грубо говоря) вытеснению другого кислотного оксида (углекислого газа из карбоната натрия) и образованию силиката натрия
SiO2 + Na2CO3 = Na2SiO3 + CO2↑
Вещество Y - (4) - CaCl2
В результате реакции обмена между хлоридом кальция и силикатом натрия → образуется силикат кальция, который выпадает в осадок, и хлорид натрия
CaCl2 + Na2SiO3 = CaSiO3↓ + 2NaCl
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7001.
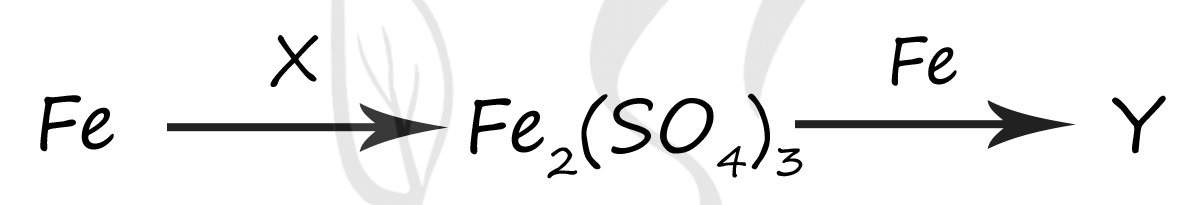
1) FeS
2) H2SO4(конц.)
3) FeSO4
4) H2SO4(разб.)
5) FeSO3
Верный ответ: 23
Вещество X - (2) - H2SO4(конц.)
Концентрированная серная кислота является сильным окислителем который окисляет железо до степени окисления +3, при очень высокой концентрации кислоты побочным продуктом будет сернистый газ
2Fe + 6H2SO4 = Fe2(SO4)3 + 3SO2 + 6H2O
Вещество Y - (3) - FeSO4
Эта реакция относится к реакциям по типу золотой середины: встречаются два атома железа +3 из сульфата железа (III) и железо в степени окисления 0 → промежуточная для них степень окисления будет +2, поэтому образуется сульфат железа (II)
Fe2(SO4)3 + Fe = 3FeSO4
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6966.
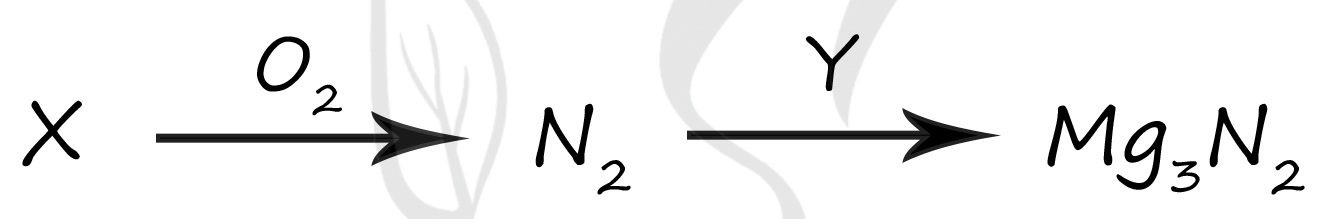
1) MgO
2) NH3
3) HNO2
4) Mg(OH)2
5) Mg
Верный ответ: 25
Вещество X - (2) - NH3
При отсутствии катализаторов или особых условий (ооочень высокие температуры) азотсодержащие вещества всегда сгорают до азота (а не его оксидов)
4NH3 + 3O2 = 2N2 + 6H2O
Вещество Y - (5) - Mg
Нитриды образуются при реакциях азота с металлами
3Mg + N2 = Mg3N2
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6931.

1) Ca(ClO)2
2) NaOH(р-р. 10 °C)
3) Br2
4) AlCl3
5) NaOH(р-р. 100 °C)
Верный ответ: 15
Вещество X - (1) - Ca(ClO)2
Данная реакция относятся к типу золотой середины, где встречаются хлор +1 из гипохлорита и хлор -1 из хлороводорода: оба превращаются в простое вещество хлор в степени окисления 0 (кроме атомов хлора никто степень окисления в реакции не меняет)
Ca(ClO)2 + 4HCl = CaCl2 + 2H2O + 2Cl2
Вещество Y - (5) - NaOH(р-р. 100 °C)
В данном случае следует выбрать именно горячий раствор гидроксида натрия, так как в таких условиях происходит окисление хлора до степени +5 (на холоде это максимум был бы гипохлорит)
3Cl2 + 6NaOH = 5NaCl + NaClO3 + 3H2O
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6896.