


1. Определим степень изотермического сжатия, при которой пар станет насыщенным.
При этом учтём, что при 100 °С давление насыщенного водяного пара равно
нормальному атмосферному давлению \( {p_н} = {p_{атм}} = {10^5} \) Па. Для этого воспользуемся
законом Бойля-Мариотта \( {p_{п1}}{V_1} = {p_н}{V_н} \). Поскольку начальная относительная влажность воздуха равна:
\( \varphi = \frac{{{p_{п1}}}}{{{p_н}}} = 0,6 \), то
\( \frac{{{V_1}}}{{{V_н}}} = \frac{{{p_н}}}{{{p_{п1}}}} = \)\( \frac{{{p_н}}}{{0,6{p_н}}} = \frac{{5}}{3} < 2,5 \)
Следовательно, при изотермическом уменьшении объёма в 2,5 раза пар станет насыщенным.
2. Определим начальное и конечное парциальное давление сухого воздуха,
воспользовавшись законами Дальтона и Бойля-Мариотта:
\( {p_{в1}} = {p_1} - {p_{п1}} = {p_1} - \varphi {p_н} \) \( = {10^5} - 0,6 \cdot {10^5} = 0,4 \cdot {10^5} \) Па,
\( {p_{в2}} = \frac{{{p_{в1}}{V_1}}}{{{V_2}}} = \)\( 2,5 \cdot 0,4 \cdot {10^5} = {10^5} \) Па
3. Определим конечное давление влажного воздуха в сосуде с помощью закона
Дальтона:
\( {p_2} = {p_{в2}} + {p_{п2}} = {p_{в2}} + {p_н} \) \( = {10^5} + {10^5} = 2 \cdot {10^5} \) Па.
4. При нагревании влажного воздуха без изменения объёма водяной пар будет
оставаться ненасыщенным, а значит, влажный воздух можно считать идеальным
газом с постоянным количеством вещества, для изохорного нагревания которого
можно применить закон Шарля: \( \frac{{{p_1}}}{{{T_1}}} = \frac{{{p_2}}}{{{T_2}}} \). Таким образом, для того чтобы получить
такое же конечное давление без изменения объёма, абсолютную температуру газа необходимо увеличить в
\( \frac{{{T_2}}}{{{T_1}}} = \frac{{{p_2}}}{{{p_1}}} = \frac{{2 \cdot {{10}^5}}}{{{{10}^5}}} = 2 \) раза
Ответ: \( \frac{{{T_2}}}{{{T_1}}} \) = 2
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 21514.
1. Определим степень изотермического сжатия, при которой пар станет насыщенным.
При этом учтём, что при 100 °С давление насыщенного водяного пара равно
нормальному атмосферному давлению \( {p_н} = {p_{атм}} = {10^5} \) Па. Для этого воспользуемся
законом Бойля-Мариотта \( {p_{п1}}{V_1} = {p_н}{V_н} \). Поскольку начальная относительная влажность воздуха равна:
\( \varphi = \frac{{{p_{п1}}}}{{{p_н}}} = 0,7 \), то
\( \frac{{{V_1}}}{{{V_н}}} = \frac{{{p_н}}}{{{p_{п1}}}} = \)\( \frac{{{p_н}}}{{0,7{p_н}}} = \frac{{10}}{7} < 3 \)
Следовательно, при изотермическом уменьшении объёма в 3 раза пар станет насыщенным.
2. Определим начальное и конечное парциальное давление сухого воздуха,
воспользовавшись законами Дальтона и Бойля-Мариотта:
\( {p_{в1}} = {p_1} - {p_{п1}} = {p_1} - \varphi {p_н} \) \( = {10^5} - 0,7 \cdot {10^5} = 0,3 \cdot {10^5} \) Па,
\( {p_{в2}} = \frac{{{p_{в1}}{V_1}}}{{{V_2}}} = \)\( 3 \cdot 0,3 \cdot {10^5} = 0,9 \cdot {10^5} \) Па
3. Определим конечное давление влажного воздуха в сосуде с помощью закона
Дальтона:
\( {p_2} = {p_{в2}} + {p_{п2}} = {p_{в2}} + {p_н} \) \( = {10^5} + 0,9 \cdot {10^5} = 1,9 \cdot {10^5} \) Па.
4. При нагревании влажного воздуха без изменения объёма водяной пар будет
оставаться ненасыщенным, а значит, влажный воздух можно считать идеальным
газом с постоянным количеством вещества, для изохорного нагревания которого
можно применить закон Шарля: \( \frac{{{p_1}}}{{{T_1}}} = \frac{{{p_2}}}{{{T_2}}} \). Таким образом, для того чтобы получить
такое же конечное давление без изменения объёма, абсолютную температуру газа необходимо увеличить до
\( {T_2} = {T_1}\frac{{{p_2}}}{{{p_1}}} = \) \( 373 \cdot \frac{{1,9 \cdot {{10}^5}}}{{{{10}^5}}} \) ≈ 709 К
Ответ: T2 ≈ 709 К
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 21507.
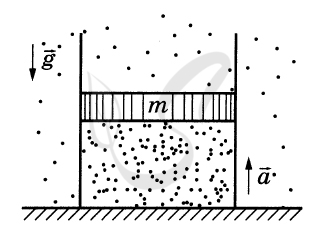

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 21500.
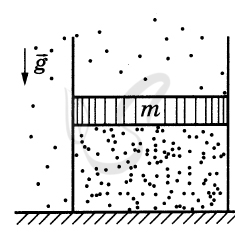
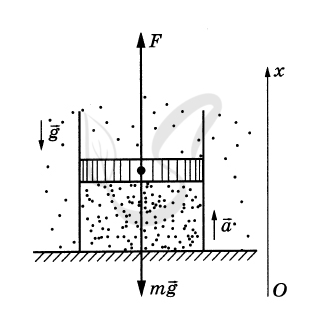
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 21493.
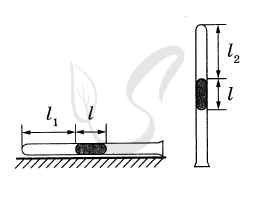
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 21486.
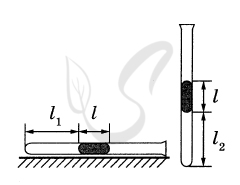
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 21478.
1. Водяной пар в воздухе до момента конденсации является разреженным газом
и описывается уравнением Менделеева — Клапейрона: \( pV = \frac{m}{M}RT \), где \( p \) —
парциальное давление пара, \( m \) — масса пара в рассматриваемом объёме \( V \), \( T \) —
абсолютная температура, а \( M \) = 18 · 10-3 кг/моль — молярная масса воды
При комнатной температуре \( {T_1} \), и парциальном давлении \( {p_1} \) в выделенном объёме \( V \)
содержится \( {m_1} = M\frac{{{p_1}V}}{{R{T_1}}} \) водяного пара, а в выдыхаемом воздухе при температуре \( {T_2} \) и парциальном давлении \( {p_2} \) содержится \( {m_2} = M\frac{{{p_2}V}}{{R{T_2}}} \)
2. Масса испарённой воды в этом объёме:
\( m = {m_2} - {m_1} = M\frac{{{p_2}V}}{{R{T_2}}} \)\( - M\frac{{{p_1}V}}{{R{T_1}}} = \frac{{MV}}{R}\left( {\frac{{{p_2}}}{{{T_2}}} - \frac{{{p_1}}}{{{T_1}}}} \right) \)
При \( {t_1} \) = 20 °С (\( {T_1} \) = 273 + 20 = 293 К) и относительной влажности 40 % парциальное
давление водяного пара \( {p_1} = 0,4{p_{н1}} = 0,4 \cdot 2,34 \cdot {10^3} \) Па = 936 Па, а при \( {t_2} \) = 34 °С (\( {T_2} \) = 273 + 34 = 307 К) и относительной влажности 100 % парциальное давление
водяного пара \( {p_2} = {p_{н2}} = 5320 \) Па
Здесь \( {p_{н1}} = 2,34 \cdot {10^3} \) Па — давление насыщенного водяного пара при \( {t_1} \) = 20 °С,
а \( {p_{н2}} \) = 5320 Па — давление насыщенного водяного пара при \( {t_2} \) = 34 °С
3. Через лёгкие за 1 мин проходит 15 л воздуха, а за 1 ч. — 900 л,
т.е. \( V \) = 0,9 м3. Подставляя значения физических величин, получим количество
потерянной за час воды:
\( m = \frac{{MV}}{R}\left( {\frac{{{p_2}}}{{{T_2}}} - \frac{{{p_1}}}{{{T_1}}}} \right) = \)\( \frac{{18 \cdot {{10}^{ - 3}} \cdot 0,9}}{{8,31}} \cdot \left( {\frac{{5320}}{{307}} - \frac{{936}}{{293}}} \right) \) ≈ 27,6 · 10-3 кг = 27,6 г
Ответ: m ≈ 27,6 г
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 21470.
1. Водяной пар в воздухе до момента конденсации является разреженным газом
и описывается уравнением Менделеева — Клапейрона: \( pV = \frac{m}{M}RT \), где \( p \) —
парциальное давление пара, \( m \) — масса пара в рассматриваемом объёме \( V \), \( T \) —
абсолютная температура, а \( M \) = 18 · 10-3 кг/моль — молярная масса воды
При комнатной температуре \( {T_1} \), и парциальном давлении \( {p_1} \) в выделенном объёме \( V \)
содержится \( {m_1} = M\frac{{{p_1}V}}{{R{T_1}}} \) водяного пара, а в выдыхаемом воздухе при температуре \( {T_2} \) и парциальном давлении \( {p_2} \) содержится \( {m_2} = M\frac{{{p_2}V}}{{R{T_2}}} \)
2. Масса испарённой воды в этом объёме:
\( m = {m_2} - {m_1} = M\frac{{{p_2}V}}{{R{T_2}}} \)\( - M\frac{{{p_1}V}}{{R{T_1}}} = \frac{{MV}}{R}\left( {\frac{{{p_2}}}{{{T_2}}} - \frac{{{p_1}}}{{{T_1}}}} \right) \)
При \( {t_1} \) = 17 °С (\( {T_1} \) = 273 + 17 = 290 К) и относительной влажности 40 % парциальное
давление водяного пара \( {p_1} = 0,6{p_{н1}} = 0,6 \cdot 1,94 \cdot {10^3} \) Па = 1164 Па, а при \( {t_2} \) = 34 °С (\( {T_2} \) = 273 + 34 = 307 К) и относительной влажности 100 % парциальное давление
водяного пара \( {p_2} = {p_{н2}} = 5320 \) Па
Здесь \( {p_{н1}} = 1,94 \cdot {10^3} \) Па — давление насыщенного водяного пара при \( {t_1} \) = 17 °С,
а \( {p_{н2}} \) = 5320 Па — давление насыщенного водяного пара при \( {t_2} \) = 34 °С
3. Через лёгкие за 1 мин проходит 15 л воздуха, а за 20 мин. — 300 л,
т.е. \( V \) = 0,3 м3. Подставляя значения физических величин, получим количество
потерянной за час воды:
\( m = \frac{{MV}}{R}\left( {\frac{{{p_2}}}{{{T_2}}} - \frac{{{p_1}}}{{{T_1}}}} \right) = \)\( \frac{{18 \cdot {{10}^{ - 3}} \cdot 0,3}}{{8,31}} \cdot \left( {\frac{{5320}}{{307}} - \frac{{1164}}{{290}}} \right) \) ≈ 8,65 · 10-3 кг = 8,65 г
Ответ: m ≈ 8,65 г
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 21462.
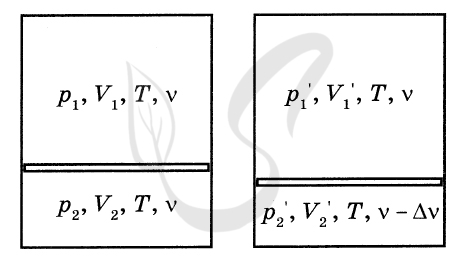
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 21454.
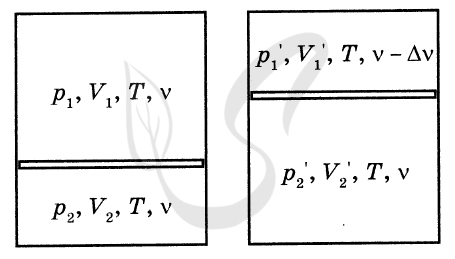
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 21446.