

Верный ответ: 3121
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7225.
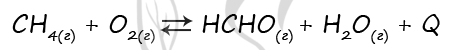
Верный ответ: 2231
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7190.
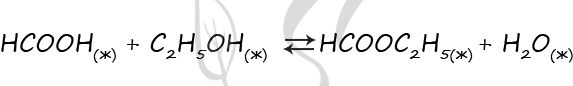
Верный ответ: 3221
При добавлении NaOH (В) пойдет реакция с кислотой, ее концентрация уменьшится, в результате равновесие сместится в сторону обратной реакции (2).
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7155.
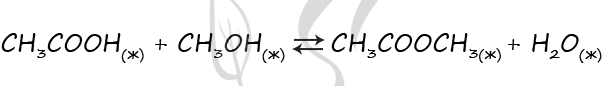
Верный ответ: 2231
В ходе реакции гидроксида меди (II) с уксусной кислотой будет происходить растворение гидроксида меди с образованием прозрачного голубого раствора: уксусная кислота будет расходоваться, за счет чего равновесие сместится влево - в сторону обратной реакции (2) - в ту часть уравнения, где находится уксусная кислота.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7120.
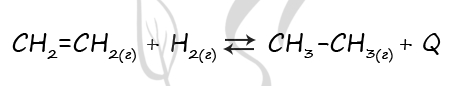
Верный ответ: 1312
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7085.