


1) Уравнения реакций
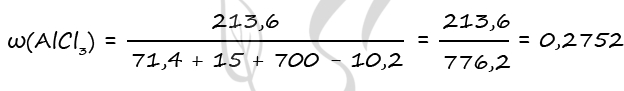
Al2O3 + 6HCl = 2AlCl3 + 3H2O (1)
Al2S3 + 6HCl = 2AlCl3 + 3H2S↑ (2)
H2S + CuSO4 = CuS↓ + H2SO4 (3)
2) Вычислим количество Al2O3
m(CuSO4) = 240 ⋅ 0,2 = 48 г
n(CuSO4) = 48 : 160 = 0,3 моль
n(CuSO4) = n(H2S) = 0,3 моль (по уравнению 3)
n(Al2S3) = 1/3 ⋅ n(H2S) = 1/3 ⋅ 0,3 = 0,1 моль (по уравнению 2)
m(Al2S3) = 0,1 ⋅ 150 = 15 г
n(Al)в Al2S3 = n(Al2S3) ⋅ 2 = 0,1 ⋅ 2 = 0,2 моль
m(Al)в Al2S3 = 0,2 ⋅ 27 = 5,4 г
Примем x = n(Al2O3)
n(Al)в Al2O3 = n(Al) ⋅ 2 = 2x моль
m(Al2O3) = x ⋅ 102 = 102x (г)
m(Al)в Al2O3 = 2x ⋅ 27 = 54x (г)
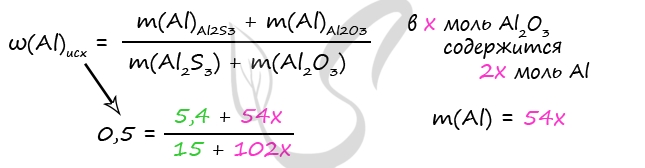

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7935.
1) Уравнения реакций
Cu + 2H2SO4 = CuSO4 + SO2↑ + 2H2O (1)
CuO + H2SO4 = CuSO4 + H2O (2)
NaOH + SO2 = NaHSO3 (3)
2) Вычислим массу CuO
m(NaOH) = 200 ⋅ 0,1 = 20 г
n(NaOH) = 20 : 40 = 0,5 моль
n(NaOH) = n(SO2) = n(Cu) = 0,5 по уравнению 1 и 3
m(Cu) = 0,5 ⋅ 64 = 32 г
Примем x = n(CuO) = n(Cu)в CuO, тогда
m(Cu)в CuO = x ⋅ 64 = 64x (г)
m(CuO) = x ⋅ 80 = 80x (г)
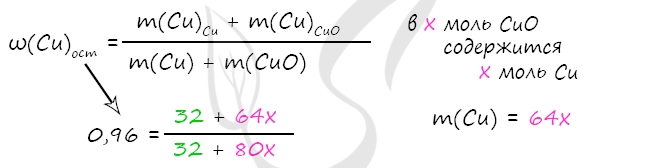
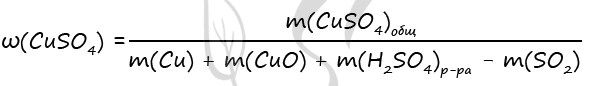
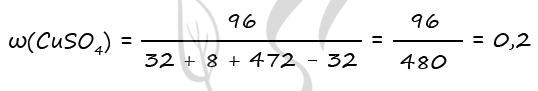
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7900.
1) Уравнения реакций
BaO2 + H2SO4 = BaSO4↓ + H2O2 (1)
BaO + H2SO4 = BaSO4↓ + H2O (2)
2) Вычислим количество вещества оксида бария и пероксида бария
m(H2SO4) = 490 ⋅ 0,2 = 98 г
n(H2SO4) = 98 : 98 = 1 моль
n(H2SO4) = n(исх. смеси) = 1 моль (по уравнению 1)
n(H2SO4) = n(BaO2) (по уравнению 1)
n(H2SO4) = n(BaSO4) (по уравнению 2)
m(H2O)исх = 490 - 98 = 392 г
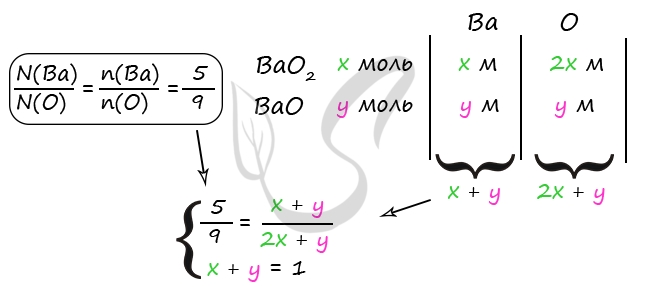
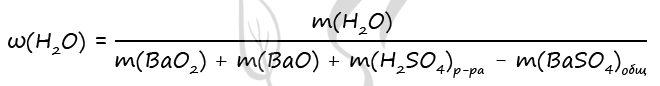
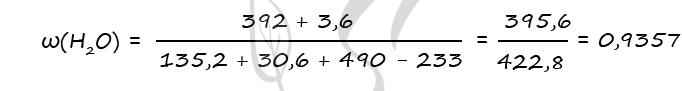
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7865.
1) Уравнения реакций
Zn + H2SO4 = ZnSO4 + H2↑ (1)
ZnCO3 + H2SO4 = ZnSO4 + H2O + CO2↑ (2)
2) Найдем количество вещества цинка и карбоната цинка
n(CO2+H2) = 2,24 : 22,4 = 0,1 моль

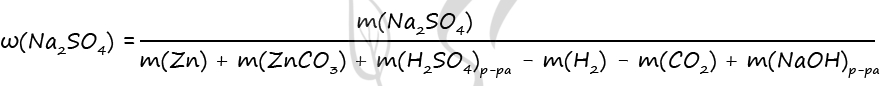
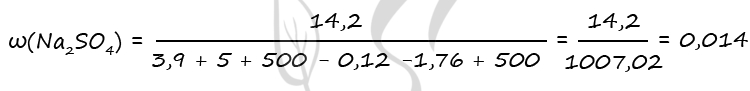
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7830.
1) Уравнения реакций
10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O (1)
Fe2(SO4)3 + 6NaOH = 2Fe(OH)3↓ + 3Na2SO4 (2)
MnSO4 + 2NaOH = Mn(OH)2↓ + Na2SO4 (3)
2) Вычислим массу исходного сульфата железа (III)
m(KMnO4) = 126,4 ⋅ 0,05 = 6,32 г
n(KMnO4) = 6,32 : 158 = 0,04 моль
n(FeSO4)исх = 5n(KMnO4) = 5 ⋅ 0,04 = 0,2 (по уравнению 1)

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7795.
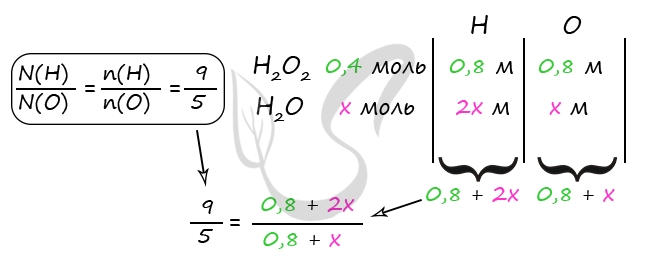
1) Уравнения реакций
H2SO4 + BaO2 = BaSO4↓ + H2O2 (1)
2H2O2 = (кат. MnO2) 2H2O + O2↑ (2)
2) Вычислим количество воды в исходном растворе
Δm = m(O2) = 6,4 г
n(O2) = 6,4 : 32 = 0,2 моль
2n(O2) = n(H2O2) = n(H2SO4) = 0,4 моль (по уравнению 1 и 2)
m(H2SO4) = 0,4 ⋅ 98 = 39,2 г
Примем n(H2O) = x моль
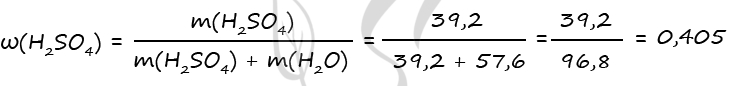
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7760.
1) Уравнения реакций
Ca + 2HCl = CaCl2 + H2↑ (1)
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ (2)
(?) 2NaOH + CO2 = Na2CO3 + H2O (3)
(?) CO2 + NaOH = NaHCO3 (4)
2) Запишем формулу массы раствора после реакций 1 и 2
m(р-ра после реакций 1 и 2) = m(Ca) + m(CaCO3) + m(HCl)р-ра - m(H2) - m(CO2)
3) Примем n(Ca) = x моль, n(CaCO3) = y моль
m(Ca) = 40x (г)
m(CaCO3) = 100y (г)
n(Ca) = n(H2)по ур-нию 1 = x моль; m(H2) = 2x (г)
n(CaCO3) = n(CO2)по ур-нию 2 = y моль; m(CO2) = 44y (г)
Подставим все найденные значения в формулу массы раствора, записанную в пункте 2
330 = 40x + 100y + 300 - 2x - 44y
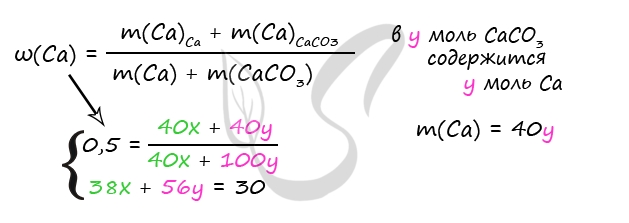
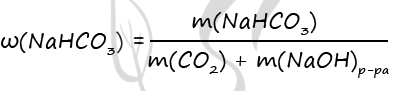
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7725.
1) Уравнения реакций
CaO + 2HCl = CaCl2 + H2O (1)
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ (2)
CO2 + NaOH = NaHCO3 (3)
CO2 + 2NaOH = Na2CO3 + H2O (4)
2) Запишем формулу массы раствора после реакций 1 и 2
m (р-ра после реакции 1, 2) = m(CaO) + m(CaCO3) + m(HCl)р-ра - m(CO2)
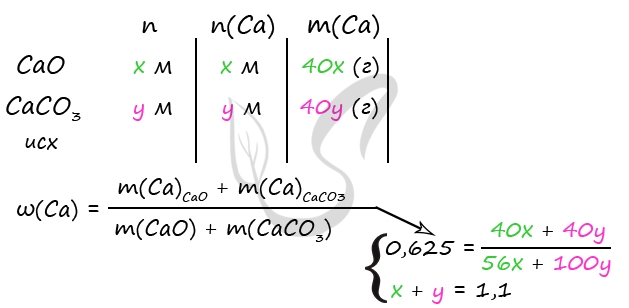
3) Примем n(CaO) = x моль, n(CaCO3) = y моль
m(CaO) = 56x (г)
m(CaCO3) = 100y (г)
n(CaCO3) = n(CO2) = y моль (по уравнению 2)
m(CO2) = 44y (г)
Составим систему уравнений:
361,6 = 56x + 100y + 300 - 44y
x + y = 1,1


P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7690.
1) Уравнения реакций
CaC2 + 2HCl = CaCl2 + C2H2↑ (1)
Al4C3 + 12HCl = 4AlCl3 + 3CH4↑ (2)
AlCl3 + 3NaHCO3 = Al(OH)3↓ + 3CO2↑ + 3NaCl (3)
CaCl2 + 2NaHCO3 = CaCO3 + CO2 + H2O + 2NaCl (4 - данная реакция не идет, так как ее обязательным условием является нагревание, о котором в тексте задачи не упоминается)
2) Вычислим массу карбида алюминия
m(NaHCO3) = 1260 ⋅ 0,08 = 100,8 г
n(NaHCO3) = 100,8 : 84 = 1,2 моль
n(AlCl3) = 1/3 ⋅ n(NaHCO3) = 1/3 ⋅ 1,2 = 0,4 моль (по уравнению 3)
n(Al4C3) = 1/4 ⋅ n(AlCl3) = 1/4 ⋅ 0,4 = 0,1 моль (по уравнению 2)
m(Al4C3) = 0,1 моль ⋅ 144 г/моль = 14,4 г
3) Вычислим количество вещества карбида кальция
Примем n(CaC2) = x моль
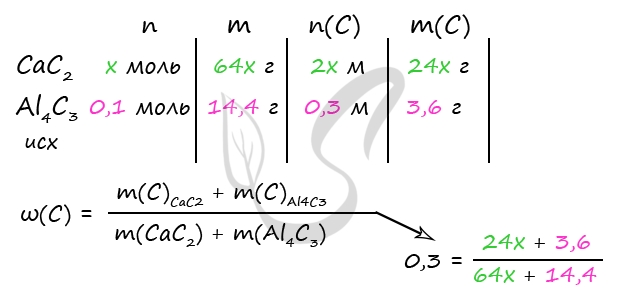
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7655.
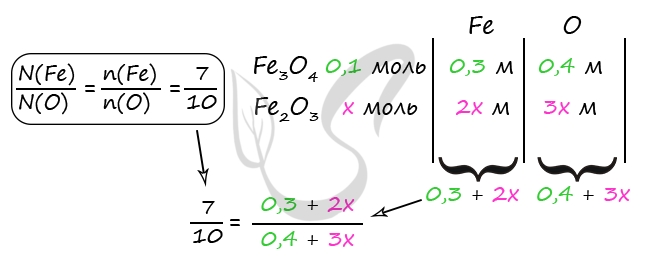
1) Уравнения реакций
Fe3O4 + 10HNO3(к) = 3Fe(NO3)3 + NO2 + 5H2O (1)
Fe2O3 + 6HNO3(к) = 2Fe(NO3)3 + 3H2O (2)
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O (3)
2) Вычислим количество Fe3O4
m(NaOH) = 20 ⋅ 0,2 = 4 г
n(NaOH) = 4 : 40 = 0,1 моль
n(NaOH) = n(NO2) = 0,1 моль (по уравнению 3)
n(Fe3O4) = n(NO2) = 0,1 моль (по уравнению 1)
3) Пусть n(Fe2O3) = x моль
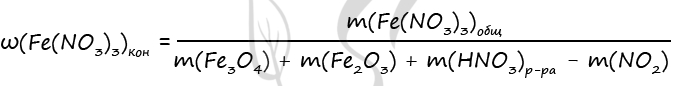
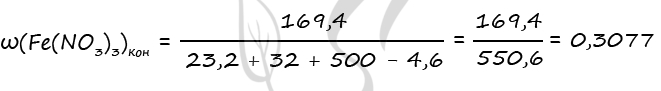
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7620.