


Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») - водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.
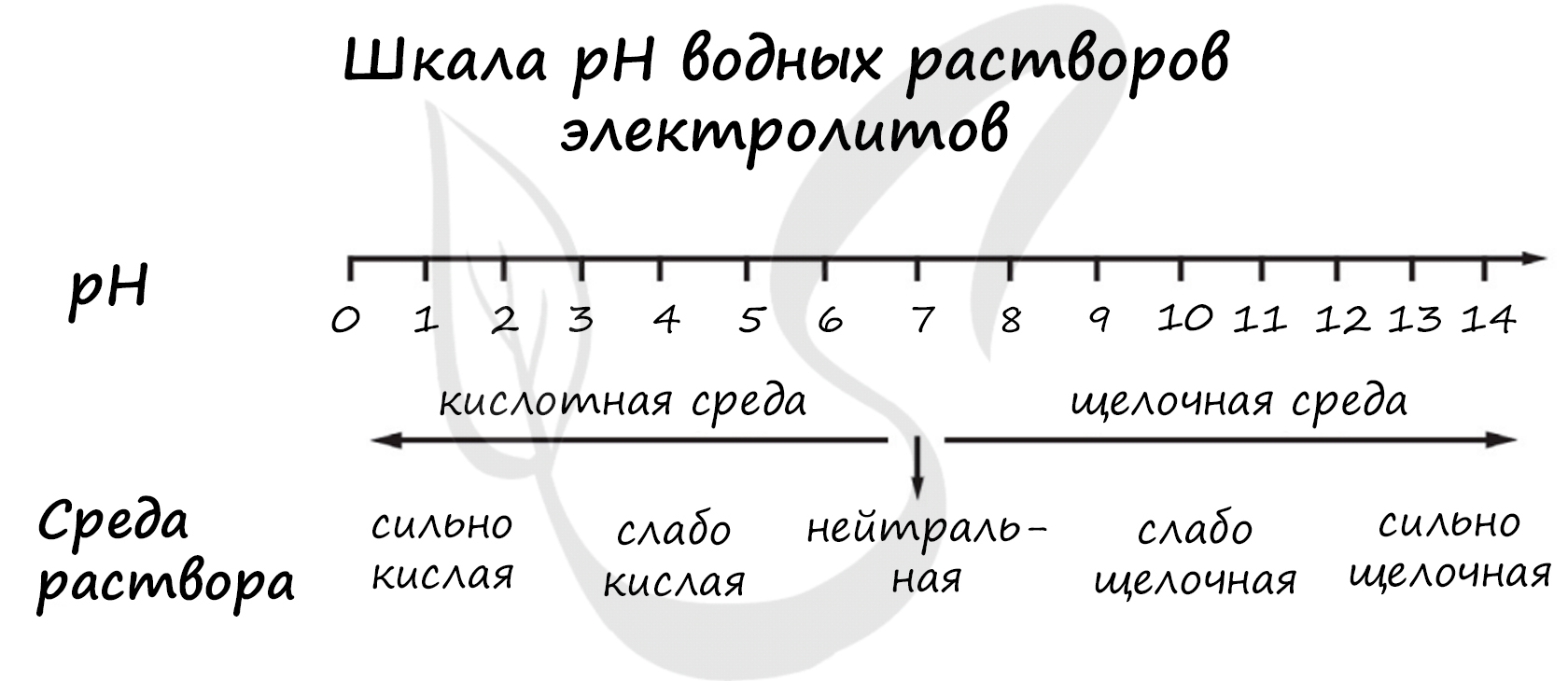
1) сульфат аммония
2) хлорноватистая кислота
3) фторид метиламмония
4) ортофосфат натрия
Верный ответ: 2134
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7224.
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») - водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.

1) HI
2) SnBr2
3) Ca(NO2)2
4) KOH
Верный ответ: 1234
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7189.
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») - водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.

1) Na2SO3
2) HClO4
3) NH4Cl
4) CaBr2
Верный ответ: 2341
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7154.
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») - водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.

1) KHCO3
2) Rb3PO4
3) KHSO4
4) LiNO3
Верный ответ: 3412
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7119.
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») - водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.

1) CaCl2
2) CsOH
3) NaHCO3
4) AlCl3
Верный ответ: 4132
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7084.
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») - водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.

1) сильвин
2) едкий натр
3) метиламин
4) диметиламин
Верный ответ: 1342
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7049.
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») - водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.

1) Rb3PO4
2) NH4MnO4
3) HCl
4) Sr(OH)2
Верный ответ: 3214
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7014.
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») - водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.

1) бертолетова соль
2) фосфат цезия
3) сульфат марганца(II)
4) гидрофосфат цезия
Верный ответ: 2413
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6979.
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») - водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.

1) C15H31COOLi
2) (NH4)2S
3) LiOH
4) NH4HS
Верный ответ: 4213
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6944.
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») - водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.

1) HClO3
2) (CH3COO)2Ba
3) KNO3
4) AlBr3
Верный ответ: 1432
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6909.