


1) Уравнение реакции электролиза
2Cu(NO3)2 + 2H2O = 2Cu + O2 + 4HNO3
2) В результате электролиза образовались медь и кислород, поэтому уменьшилась масса раствора. Вычислим количество вещества кислорода.
m(Cu + O2) = 290 - 259,6 = 30,4 г
Пусть n(O2) = x моль, n(Cu) = 2x моль, тогда
32x + 64 ⋅ 2x = 30,4
x = 0,19 моль = n(O2)
3) Рассчитаем массу и массовую долю нитрата меди(II) в исходном растворе
n(Cu(NO3)2прореаг.) = 2n(O2) = 0,38 моль
m(Cu(NO3)2прореаг.) = 0,38 ⋅ 188 = 71,44 г
m(Cu(NO3)2ост.) = 0,05 ⋅ 259,6 = 12,98 г
m(Cu(NO3)2исх.) = 71,44 + 12,98 = 84,42 г
ω(Cu(NO3)2) = 84,42 : 290 ⋅ 100% = 29,11%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7235.
1) Уравнения реакций
2NaBr + 2H2O = 2NaOH + Br2 + H2
2NaOH + CuSO4 = Cu(OH)2 + Na2SO4
2) Рассчитаем количество вещества сульфата меди(II) и гидроксида меди(II)
m(CuSO4) = 80 ⋅ 0,16 = 12,8 г
n(CuSO4) = 12,8 : 160 = 0,08 моль
n(Cu(OH)2) = 6,86 : 98 = 0,07 моль < 0,08 моль
3) Сульфат меди прореагировал не полностью, расчет по второму уравнению будем проводить по Cu(OH)2.
4) Вычислим массы веществ в растворе и массу раствора
n(Na2SO4) = n(Cu(OH)2) = 0,07 моль
m(Na2SO4) = 0,07 ⋅ 142 = 9,94 г
n(CuSO4)ост. = 0,08 - 0,07 = 0,01 моль
m(CuSO4)ост. = 0,01 ⋅ 160 = 1,6 г
mр-ра = mр-ра(NaBr) - m(Br2) - m(H2) + mр-ра(CuSO4) - m(Cu(OH)2) = 46 - 0,07 ⋅ 160 - 0,07 ⋅ 2 + 80 - 6,86 = 107,8 г
5) Вычислим массовые доли сульфата натрия и сульфата меди(II)
ω(Na2SO4) = 9,94 : 107,8 ⋅ 100% = 9,22%
ω(CuSO4)ост. = 1,6 : 107,8 ⋅ 100% = 1,48%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7200.
1) Уравнение реакции электролиза
K2S + 2H2O = 2KOH + H2 + S
2) Рассчитаем количество веществ сульфида калия и водорода
m(K2S) = 137,5 ⋅ 0,12 = 16,5 г
n(K2S) = 16,5 : 110 = 0,15 моль
n(H2) = 4,48 : 22,4 = 0,2 моль > 0,15 моль
3) Водорода выделилось больше, чем могло бы образоваться при расчете по сульфиду калия. Это означает, что протекал электролиз воды.
2H2O = 2H2 + O2
n(H2(2)) = 0,2 - 0,15 = 0,05 моль
n(O2) = 0,5n(H2 (2)) = 0,025 моль
4) Найдем количество вещества гидроксида калия и углекислого газа, установим формулу образующейся соли
n(KOH) = 2n(K2S) = 0,3 моль
n(CO2) = 13,2 : 44 = 0,3 моль
n(CO2) : n(KOH) = 0,3 : 0,3 = 1 : 1 → реакция между ними идет с образованием кислой соли
KOH + CO2 = KHCO3
5) Рассчитаем массу раствору и массовую долю в нем гидрокарбоната калия
n(KHCO3) = 0,3 моль
m(KHCO3) = 0,3 ⋅ 100 = 30 г
mр-ра = mр-ра(K2S) - m(H2) - m(S) - m(O2) + m(H2O) + m(CO2) = 137,5 - 0,2 ⋅ 2 - 0,15 ⋅ 32 - 0,025 ⋅ 32 + 50 + 13,2 = 194,7 г
ω(KHCO3) = 30 : 194,7 ⋅ 100% = 15,4%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7165.
1) Уравнения реакций
2LiCl + 2H2O = 2LiOH + H2 + Cl2
Cl2 + 2FeCl2 = 2FeCl3
2) Рассчитаем количество веществ хлорида лития, хлора и массу хлорида железа (II)
m(LiCl) = 31,875 ⋅ 0,08 = 2,55 г
n(LiCl) = 2,55 : 42,5 = 0,06 моль
n(Cl2) = 0,5n(LiCl) = 0,03 моль
n(FeCl2) = n(FeCl3) = 2n(Cl2) = 0,06 моль
3) Вычислим массу раствора и массовую долю хлорида железа (II) в растворе
m(FeCl2) = 0,06 ⋅ 127 = 7,62 г
mр-ра(FeCl2) = mр-ра(FeCl3) - m(Cl2)
mр-ра(FeCl3) = m(FeCl3) : ω(FeCl3) = 0,06 ⋅ 162,5 : 0,13 = 75 г
mр-ра(FeCl2) = 75 - 0,03 ⋅ 71 = 72,87 г
ω(FeCl2) = 7,62 : 72,87 ⋅ 100% = 10,46%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7130.
1) Уравнение реакции:
2CuSO4 + 2H2O = 2Cu + O2 + 2H2SO4
2) Рассчитаем количество сульфата меди и серной кислоты
m(CuSO4) = 80 ⋅ 0,24 = 19,2 г
n(CuSO4) = 19,2 : 160 = 0,12 моль
n(H2SO4) = n(CuSO4) = 0,12 моль
3) По соотношению серной кислоты и аммиака установим образующуюся соль и найдем ее массу
n(NH3) = 2,688 : 22,4 = 0,12 моль
n(H2SO4) : n(NH3) = 0,12 : 0,12 = 1 : 1 → реакция между ними идет с образованием кислой соли
NH3 + H2SO4 = NH4HSO4
4) Рассчитаем массу раствора и массовую долю гидросульфата аммония в растворе
n(NH4HSO4) = 0,12 моль
m(NH4HSO4) = 0,12 ⋅ 115 = 13,8 г
mр-ра = mр-ра(CuSO4) - m(Cu) - m(O2) + m(NH3) = 80 - 0,12 ⋅ 64 - 0,06 ⋅ 32 + 0,12 ⋅ 17 = 72,44 г
ω(NH4HSO4) = 13,8 : 72,44 ⋅ 100% = 19%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7095.
1) Уравнение реакций
2NaCl + 2H2O = 2NaOH + H2 + Cl2 (1)
2NaOH + 2AgNO3 = Ag2O↓ + 2NaNO3 + H2O (2)
NaCl + AgNO3 = AgCl↓ + NaNO3 (3)
2) Рассчитаем количество хлорида натрия и водорода
m(NaCl) = 227,5 ⋅ 0,18 = 40,95 г
n(NaCl) = 40,95 : 58,5 = 0,7 моль
n(H2) = 6,272 : 22,4 = 0,28 моль
3) Если бы хлорид натрия полностью подвергся электролизу, то количество выделившегося водорода составило бы 0,7 : 2 = 0,35 моль. По условию n(H2) = 0,28 моль, то есть прореагировал не весь хлорид натрия. Расчет по первому уравнению ведем по водороду.
4) Рассчитаем количество оставшегося NaCl
n(NaOH) = 2n(H2) = 0,56 моль
n(NaClразл.) = 2n(H2) = 0,56 моль
n(NaClост.) = 0,7 - 0,56 = 0,14 моль
5) Вычислим массовые доли веществ в осадке.
n(Ag2O) = 0,5n(NaOH) = 0,28 моль
m(Ag2O) = 0,28 ⋅ 232 = 64,96 г
n(AgCl) = n(NaClост.) = 0,14 моль
m(AgCl) = 0,14 ⋅ 143,5 = 20,09 г
ω(Ag2O) = 64,96 : (64,96 + 20,09) ⋅ 100% = 76,4%
ω(AgCl) = 20,09 : (64,96 + 20,09) ⋅ 100% = 23,6%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7060.
1) Уравнение реакции:
2KCl + 2H2O = 2KOH + H2 + Cl2
2) Рассчитаем количество хлорида калия и хлора
m(KCl) = 116,4 ⋅ 0,32 = 37,25 г
n(KCl) = 37,25 : 74,5 = 0,5 моль
n(Cl2) = 4,928 : 22,4 = 0,22 моль
3) Если бы хлорид калия полностью подвергся электролизу, то количество выделившегося хлора составило бы 0,5 : 2 = 0,25 моль. По условию n(Cl2) = 0,22 моль, то есть прореагировал не весь хлорид калия. Расчет по уравнению ведем по хлору.
4) Рассчитаем массы гидроксида калия и хлорид калия
n(KOH) = 2n(Cl2) = 0,44 моль
m(KOH) = 0,44 ⋅ 56 = 24,64 г
n(KClразл.) = 2n(Cl2) = 0,44 моль
n(KClост.) = 0,5 - 0,44 = 0,06 моль
m(KClост.) = 0,06 ⋅ 74,5 = 4,47 г
mр-ра = mр-ра(KCl) - m(Cl2) - m(H2) = 116,4 - 0,22 ⋅ 71 - 0,22 ⋅ 2 = 100,34 г
5) Рассчитаем массовые доли гидроксида калия и хлорида калия
ω(KOH) = 24,64 : 100,34 ⋅ 100% = 24,56 %
ω(KCl) = 4,47 : 100,34 ⋅ 100% = 4,45 %
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7025.
1) Уравнения реакций:
4Al(NO3)3 = 2Al2O3 + 12NO2 + 3O2
Al2O3 + 2KOH + 3H2O = 2K[Al(OH)4]
Al(NO3)3 + 4KOH = K[Al(OH)4] + 3KNO3
2) Вычислим количество оксида алюминия:
n(газов) = 12,32 : 22,4 = 0,55 моль
n(O2) = 3/15 n(газов) = 0,11 моль
n(Al2O3) = 2/3 n(O2) = 0,0733 моль
3) Вычислим массу оставшегося нитрата алюминия 72 мл воды
(s = 71 г/100 г воды).
В 100 г воды - 71 г Al(NO3)3
В 72 г воды - x Al(NO3)3
x = 72 ⋅ 71 : 100 = 51,12 г
Возможно вычисление массу оставшегося нитрата алюминия через массовую долю:
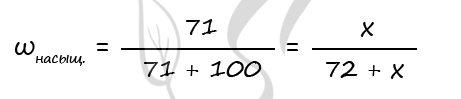
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6990.
1) Запишем уравнения реакций:
(1) Mg + 2HCl = MgCl2 + H2
(2) MgO + 2HCl = MgCl2 + H2O
(3) MgCl2(р-р) + 6H2O(ж) → MgCl2 · 6H2O↓ (выпадение в осадок КГ(кристаллогидрата), писать данную реакцию необязательно)
2) Вычислим количества исходных веществ:
n(H2) = V : Vm = 2,24 : 22,4 = 0,1 моль
n(Mg) = n(H2) = 0,1 моль
m(Mg) = n · M = 0,1 · 24 = 2,4 г
m(MgO) = 16 - 2,4 = 13,6 г
n(MgO) = m : M = 13,6 : 40 = 0,34 моль
3) Составим уравнение для вычисления количества кристаллогидрата:
n(HCl) = 2n(Mg) + 2n(MgO) = 0,88 моль
mр-ра(HCl) = n · M : ω = 0,88 · 36,5 : 0,25 = 128,48 г
mитог. р-ра = mр-ра(HCl) + m(смеси) - m(H2) = 128,48 + 16 - 0,1 · 2 = 144,28 г
n(MgCl2) = n(Mg) + n(MgO) = 0,44 моль
m(MgCl2) = n · M = 0,44 · 95 = 41,8 г
144,28 : 36,07 = 4 ⇒ в порции будет 41,8 : 4 = 10,45 г MgCl2
Масса порции после упаривания равна 36,07 - 7,8 = 28,27 г
Пусть в осадок выпало x моль КГ, тогда mв. КГ(MgCl2) = 95x, m(MgCl2 · 6H2O) = 203x
В 153 г раствора - 53 г соли
В (28,27 - 203x) г раствора - (10,45 - 95x) г соли
153 · (10,45 - 95x) = 53 · (28,27 - 203x)
x = 0,0266 моль
4) Вычислим массу КГ
m(MgCl2 · 6H2O) = 203x = 203 · 0,0266 = 5,3998 г
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6955.
1) Уравнения реакций
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
2NaOH + SO2 = Na2SO3 + H2O
2) Вычислим теоретическое количество газа
n(Cu) = m : M = 12,8 : 64 = 0,2 моль
nтеор.(SO2) = n(Cu) = 0,2 моль
3) Вычислим практическое количество газа
mнасыщ. р-ра = 83,16 - 1,26 = 81,9 г
В 130 г р-ра - 30 г соли
В 81,9 г р-ра - х г соли
х = 30 · 81,9 : 130 = 18,9 г
mобщ.(Na2SO3) = 18,9 + 1,26 = 20,16 г
n(Na2SO3) = m : M = 20,16 : 126 = 0,16 моль
nпракт.(SO2) = n(Na2SO3) = 0,16 моль
4) Вычислим выход
η = nпракт.(SO2) : nтеор.(SO2) · 100% = 0,16 : 0,2 · 100% = 80%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6920.