

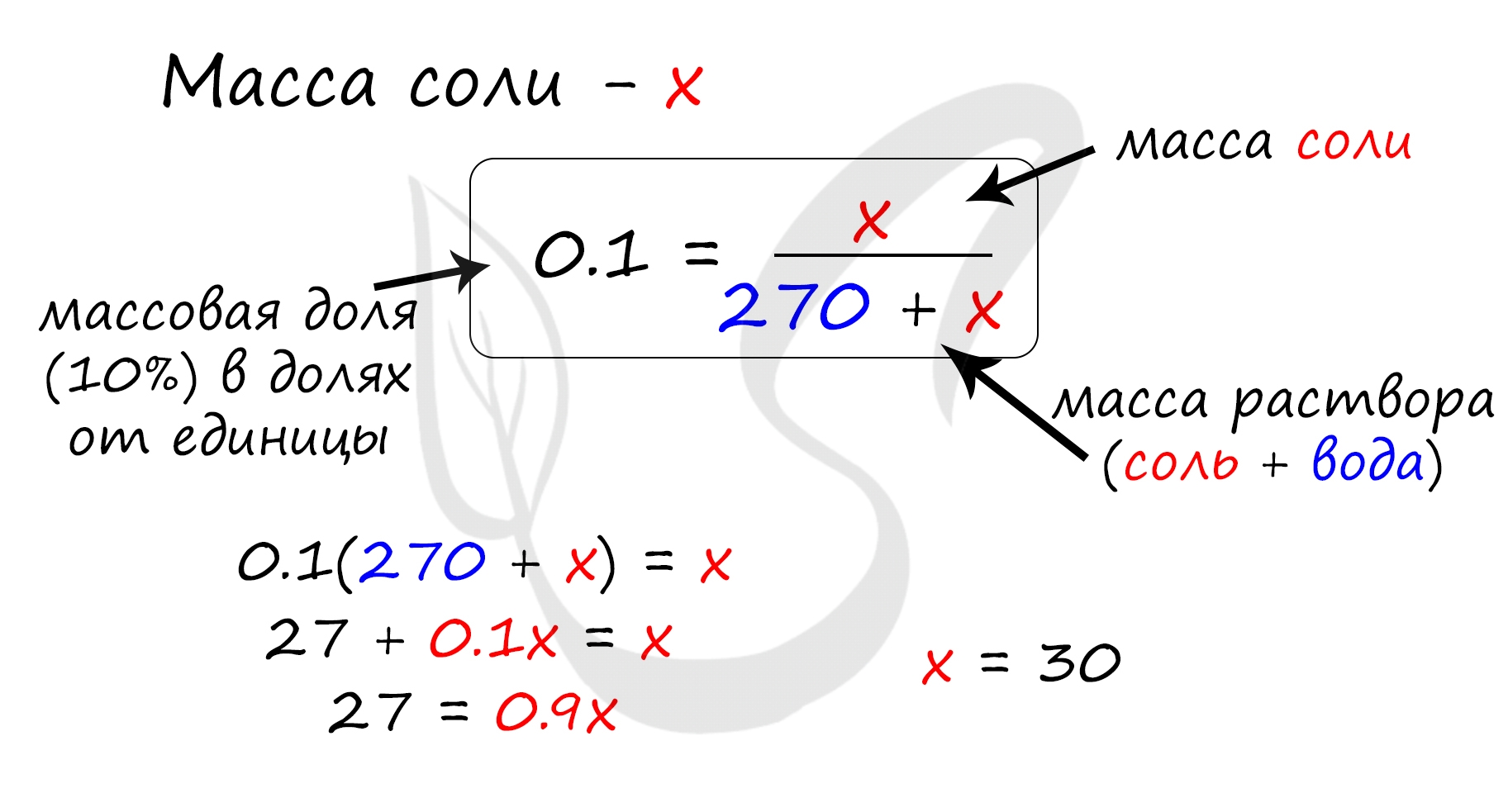
Верный ответ: 30
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7858.

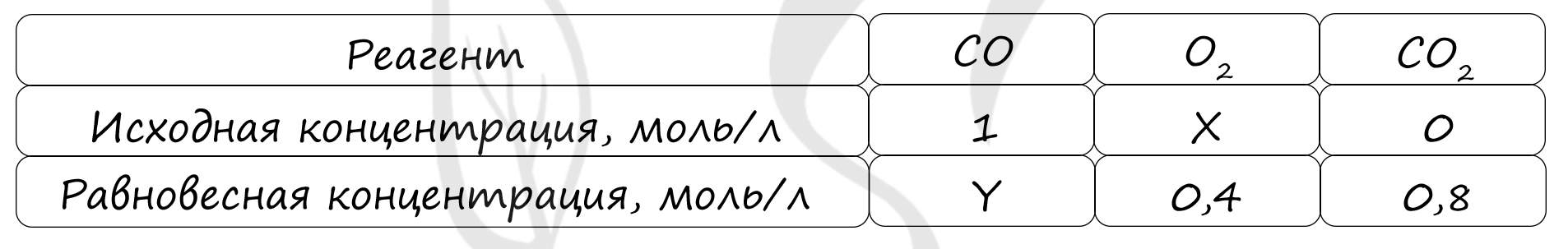
Верный ответ: 62
Таблица (по условиям задания)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7837.
1) Молярная масса углеводорода
M(CnH2n-6) = 27,6 : 0,3 = 92 г/моль
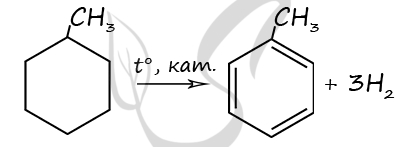
Установлена молекулярная формула ароматического углеводорода:
M(CnH2n-6) = 12n + 2n - 6 = 92
14n = 98
n = 7
Молекулярная формула - C7H8
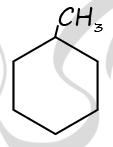
2) Структурная формула метилциклогексана
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7831.
1) Уравнения реакций
Zn + H2SO4 = ZnSO4 + H2↑ (1)
ZnCO3 + H2SO4 = ZnSO4 + H2O + CO2↑ (2)
2) Найдем количество вещества цинка и карбоната цинка
n(CO2+H2) = 2,24 : 22,4 = 0,1 моль

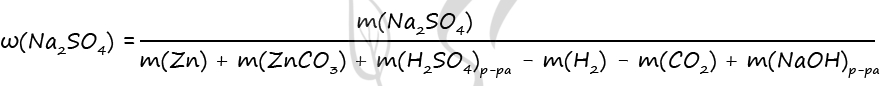
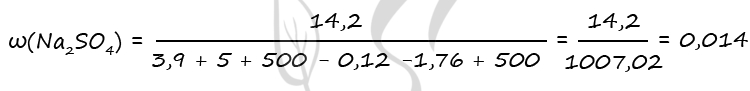
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7830.
Верный ответ: 25
Найдем массу соли, которая присутствует в исходном растворе:
m(соли) = 130 · 0.2 = 26 грамм
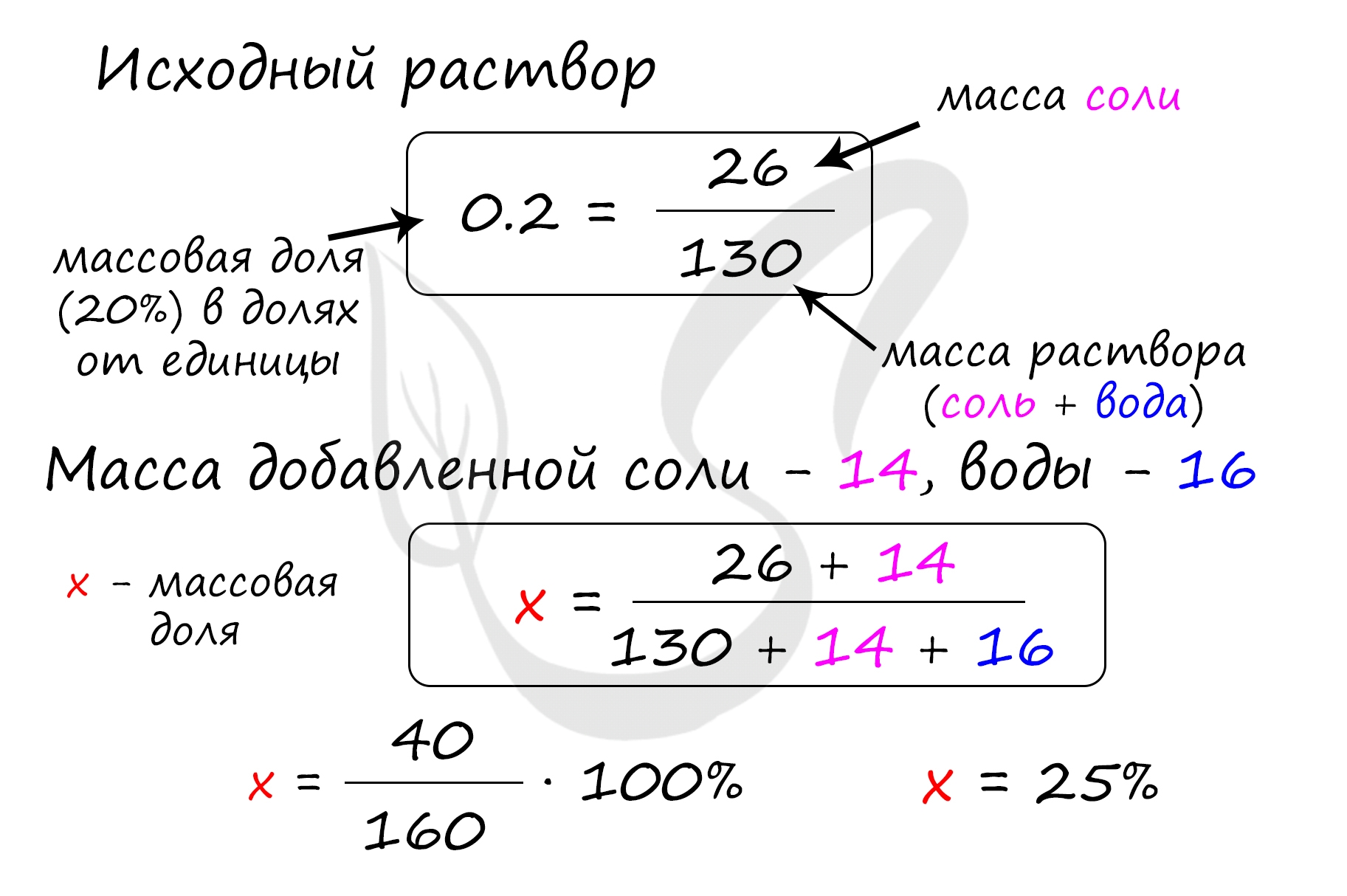
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7823.