

1) Найдем количества веществ продуктов сгорания
n(CO2) = 3,584 ⋅ 22,4 = 0,16 моль
n(H2O) = 3,24 : 18 = 0,18 моль
n(H) = 2n(H2O) = 0,18 ⋅ 2 = 0,36 моль
n(N2) = 0,448 : 22,4 = 0,02 моль
n(N) = 0,02 ⋅ 2 = 0,04 моль
2) Сделаем проверку на кислород, установим молекулярную формулу вещества
m(C + H + N) = 0,16 ⋅ 12 + 0,36 ⋅ 1 + 0,04 ⋅ 14 = 2,84 г
m(O) = 4,12 - 2,84 = 1,28 г
n(O) = 1,28 / 16 = 0,08 моль
n(C) : n(H) : n(N) : n(O) = 0,16 : 0,36 : 0,04 : 0,08 = 4 : 9 : 1 : 2
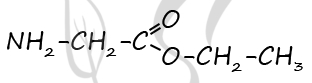
Молекулярная формула - C4H9NO2
2) Составлена структурная формула вещества
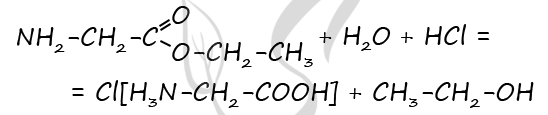
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7411.
I способ решения
1) Пусть М(М) = m(М) = x г, а масса пластинки – у г. Тогда можно составить систему уравнений:
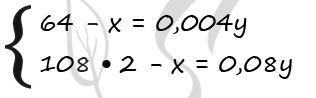
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7410.
Верный ответ: 5
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7403.
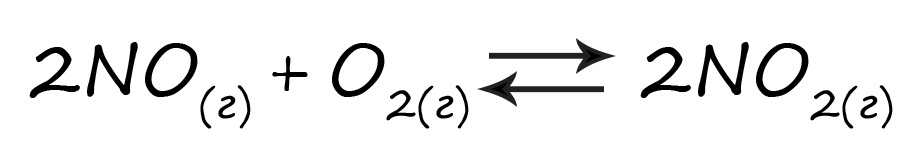
Верный ответ: 35
Таблица (по условию задания)

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7382.
1) Вычислим молярную массу
n(CnH2n+2) = 0,672 : 22,4 = 0,03 моль
M(CnH2n+2) = 0,9 : 0,03 = 30 г/моль
M(CnH2n+2) = 12n + 2n = 30
14n = 28
n = 2
молекулярная формула алкана C2H6
2) Установлена структурная формула исходного органического вещества:
NaOOC-CH2-CH2-COONa
3) Уравнение реакции
NaOOC-CH2-CH2-COONa + 2NaOH = C2H6 + 2Na2CO3
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7376.