

Верный ответ: 40
Найдем массу соли, которая присутствует в конечном растворе:
m(соли) = 160 · 0.18 = 28.8 грамм

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7333.
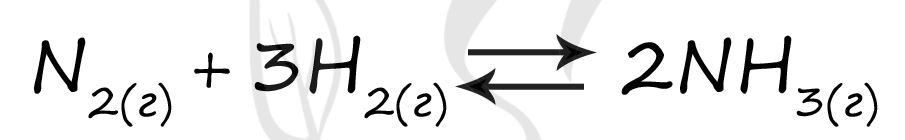
Верный ответ: 65
Таблица (по условиям задания)

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7312.
1) Вычислим количество вещества продуктов, массу и количество вещества кислорода
n(CO2) = 17,92 / 22,4 = 0,8 моль
n(C) = n(CO2) = 0,8 моль
n(H2O) = 18 / 18 = 1 моль
n(H) = 2n(H2O) = 2 моль
m(C + H) = 0,8 ⋅ 12 + 2 = 11,6 г
m(O) = 14,8 - 11,6 = 3,2 г
n(O) = 3,2 / 16 = 0,2 моль
Соотношение: C : H : O = 0,8 : 2 : 0,2 = 4 : 10 : 1
Простейшая формула C4H10O
2) Структурная формула CH3-CH2-CH2-CH2-OH
3) Уравнение реакции
CH3-CH2-CH2-CH2-OH + CuO = CH3-CH2-CH2-CHO + Cu +H2O
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7306.
1) Уравнение реакции
СuSO4 + Fe = FeSO4 + Сu
2) Если бы она произошла строго в соответствии с уравнением, растворение 1 моль железа пластинки привело бы к выделению на ней 1 моль меди, а изменение массы пластинки составило бы 8 г (64 - 56 = 8).
Так как в соответствии с условием масса пластинки изменилась только на 0,8 г, можно вычислить и количество, и массу меди, появившейся на пластинке: 0,8 : 8 = 0,1 моль меди или 0,1 ⋅ 64 = 6,4 г меди.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7305.
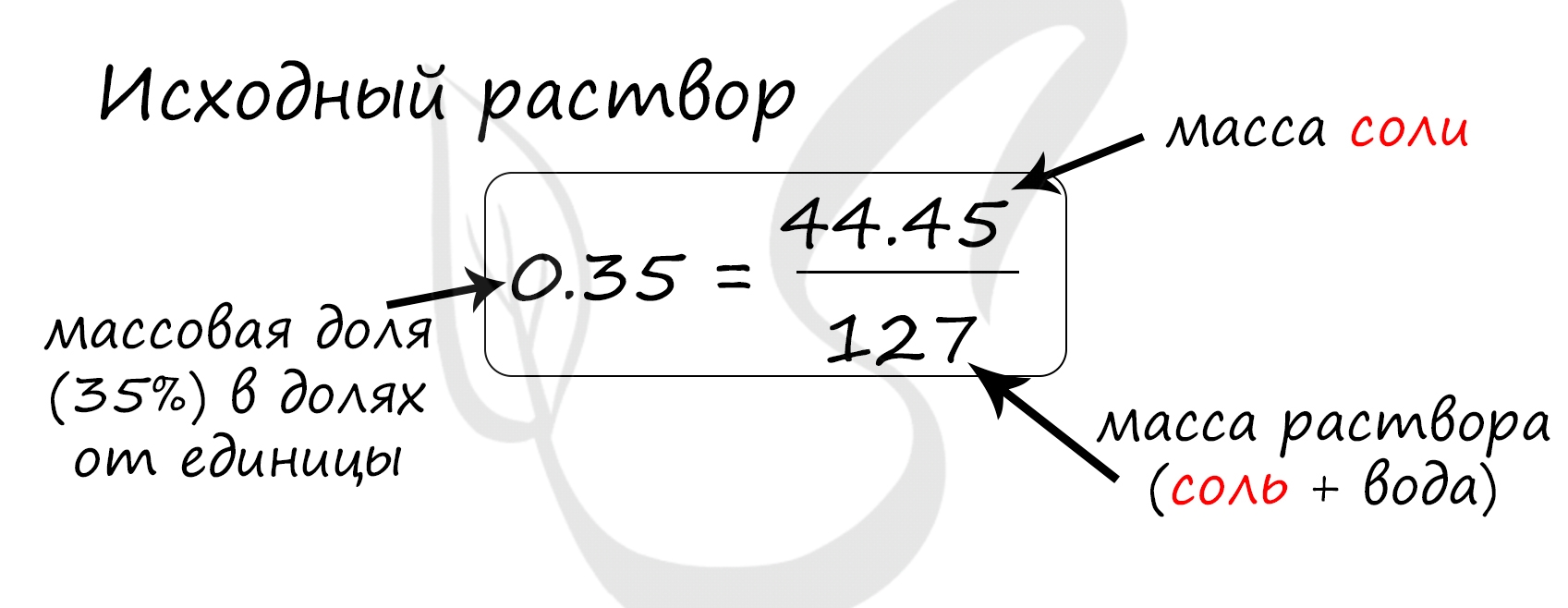
Верный ответ: 44,45
Найдем массу соли, которая присутствует в исходном растворе:
m(р-ра соли) = m · w = 100 мл · 1.27 г/мл = 127 г
m(соли) = 127 · 0.35 = 44,45 грамм
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7298.