

1) Уравнения реакций
2NaBr + 2H2O = 2NaOH + Br2 + H2
2NaOH + CuSO4 = Cu(OH)2 + Na2SO4
2) Рассчитаем количество вещества сульфата меди(II) и гидроксида меди(II)
m(CuSO4) = 80 ⋅ 0,16 = 12,8 г
n(CuSO4) = 12,8 : 160 = 0,08 моль
n(Cu(OH)2) = 6,86 : 98 = 0,07 моль < 0,08 моль
3) Сульфат меди прореагировал не полностью, расчет по второму уравнению будем проводить по Cu(OH)2.
4) Вычислим массы веществ в растворе и массу раствора
n(Na2SO4) = n(Cu(OH)2) = 0,07 моль
m(Na2SO4) = 0,07 ⋅ 142 = 9,94 г
n(CuSO4)ост. = 0,08 - 0,07 = 0,01 моль
m(CuSO4)ост. = 0,01 ⋅ 160 = 1,6 г
mр-ра = mр-ра(NaBr) - m(Br2) - m(H2) + mр-ра(CuSO4) - m(Cu(OH)2) = 46 - 0,07 ⋅ 160 - 0,07 ⋅ 2 + 80 - 6,86 = 107,8 г
5) Вычислим массовые доли сульфата натрия и сульфата меди(II)
ω(Na2SO4) = 9,94 : 107,8 ⋅ 100% = 9,22%
ω(CuSO4)ост. = 1,6 : 107,8 ⋅ 100% = 1,48%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7200.
Верный ответ: 1800
Найдем массу соли, которая присутствует в исходном растворе:
m(соли) = 600 · 0.1 = 60 грамм

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7193.
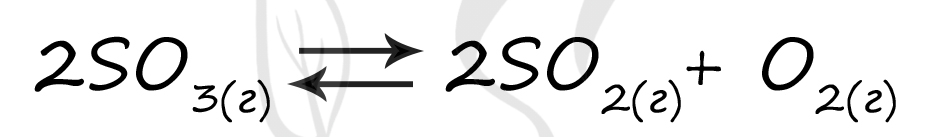
Верный ответ: 56
Таблица (по условиям задания)
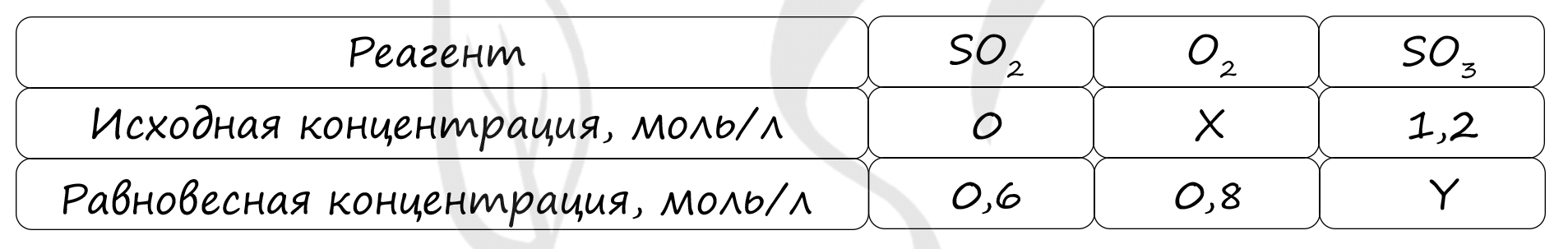
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7172.
1) Общая формула вещества - СxHyOz
n(CO2) = 8,96 : 22,4 = 0,4 моль
n(H2O) = 5,4 : 18 = 0,3 моль
M(СxHyOz) = 1,227 ⋅ 44 = 54 г/моль
n(СxHyOz) = 2,24 : 22,4 = 0,1 моль
n(C) = n(CO2) = 0,4 моль
n(H) = 2n(H2O) = 0,6 моль
m(C) + m(H) = 0,4 ⋅ 12 + 0,6 ⋅ 1 = 5,4 г (кислород отсутствует)
x = n(C) / n(СxHyOz) = 0,4 / 0,1 = 4
y = n(H) / n(СxHyOz) = 0,6 / 0,1 = 6
Молекулярная формула C4H6
2) Структурная формула HC≡C-CH2-CH3
3) Уравнение реакции этого вещества с избытком бромной воды:
HC≡C-CH2-CH3 + 2Br2(водн.) = CH(Br2)-C(Br2)-CH2-CH3
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7166.
1) Уравнение реакции электролиза
K2S + 2H2O = 2KOH + H2 + S
2) Рассчитаем количество веществ сульфида калия и водорода
m(K2S) = 137,5 ⋅ 0,12 = 16,5 г
n(K2S) = 16,5 : 110 = 0,15 моль
n(H2) = 4,48 : 22,4 = 0,2 моль > 0,15 моль
3) Водорода выделилось больше, чем могло бы образоваться при расчете по сульфиду калия. Это означает, что протекал электролиз воды.
2H2O = 2H2 + O2
n(H2(2)) = 0,2 - 0,15 = 0,05 моль
n(O2) = 0,5n(H2 (2)) = 0,025 моль
4) Найдем количество вещества гидроксида калия и углекислого газа, установим формулу образующейся соли
n(KOH) = 2n(K2S) = 0,3 моль
n(CO2) = 13,2 : 44 = 0,3 моль
n(CO2) : n(KOH) = 0,3 : 0,3 = 1 : 1 → реакция между ними идет с образованием кислой соли
KOH + CO2 = KHCO3
5) Рассчитаем массу раствору и массовую долю в нем гидрокарбоната калия
n(KHCO3) = 0,3 моль
m(KHCO3) = 0,3 ⋅ 100 = 30 г
mр-ра = mр-ра(K2S) - m(H2) - m(S) - m(O2) + m(H2O) + m(CO2) = 137,5 - 0,2 ⋅ 2 - 0,15 ⋅ 32 - 0,025 ⋅ 32 + 50 + 13,2 = 194,7 г
ω(KHCO3) = 30 : 194,7 ⋅ 100% = 15,4%
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7165.