


Верный ответ: 31
Таблица (по условию)

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7627.
1) Найдем количество вещества продуктов сгорания
n(CO2) = 16,8 : 22,4 = 0,75 моль
n(C) = 0,75 моль
m(C) = 0,75 ⋅ 12 = 9 г
n(H2O) = 13,5 : 18 = 0,75 моль
n(H) = 0,75 ⋅ 2 = 1,5 моль
m(H) = 1,5 ⋅ 1 = 1,5 г
m(O) = m(в-ва) - (m(C) + m(H)) = 10,5 - (9 + 1,5) = 0 г (кислород отсутствует)
Соотношение атомов углерода и водорода:
x : y = 0,75 : 1,5 = 3 : 6
Молекулярная формула - C3H6
M(C3H6) = 42 г/моль
M(в-ва)по усл. = 1,875 ⋅ 22,4 = 42 г/моль
Молекулярная формула - C3H6
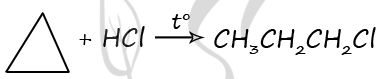
Циклопропан образует лишь одно производное в реакции с хлороводородом
2) Структурная формула вещества

P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7621.
1) Уравнения реакций
Fe3O4 + 10HNO3(к) = 3Fe(NO3)3 + NO2 + 5H2O (1)
Fe2O3 + 6HNO3(к) = 2Fe(NO3)3 + 3H2O (2)
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O (3)
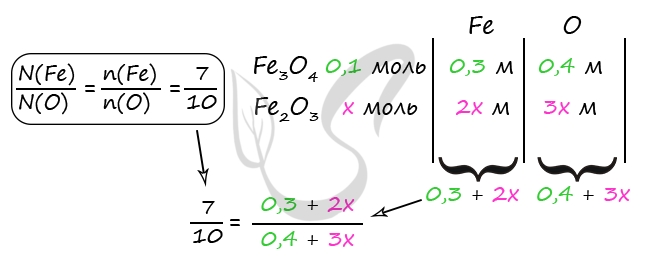
2) Вычислим количество Fe3O4
m(NaOH) = 20 ⋅ 0,2 = 4 г
n(NaOH) = 4 : 40 = 0,1 моль
n(NaOH) = n(NO2) = 0,1 моль (по уравнению 3)
n(Fe3O4) = n(NO2) = 0,1 моль (по уравнению 1)
3) Пусть n(Fe2O3) = x моль
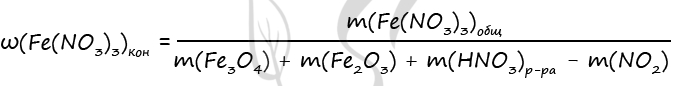
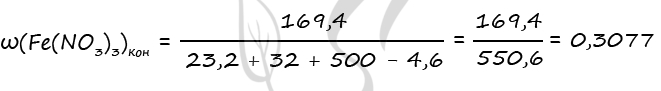
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7620.
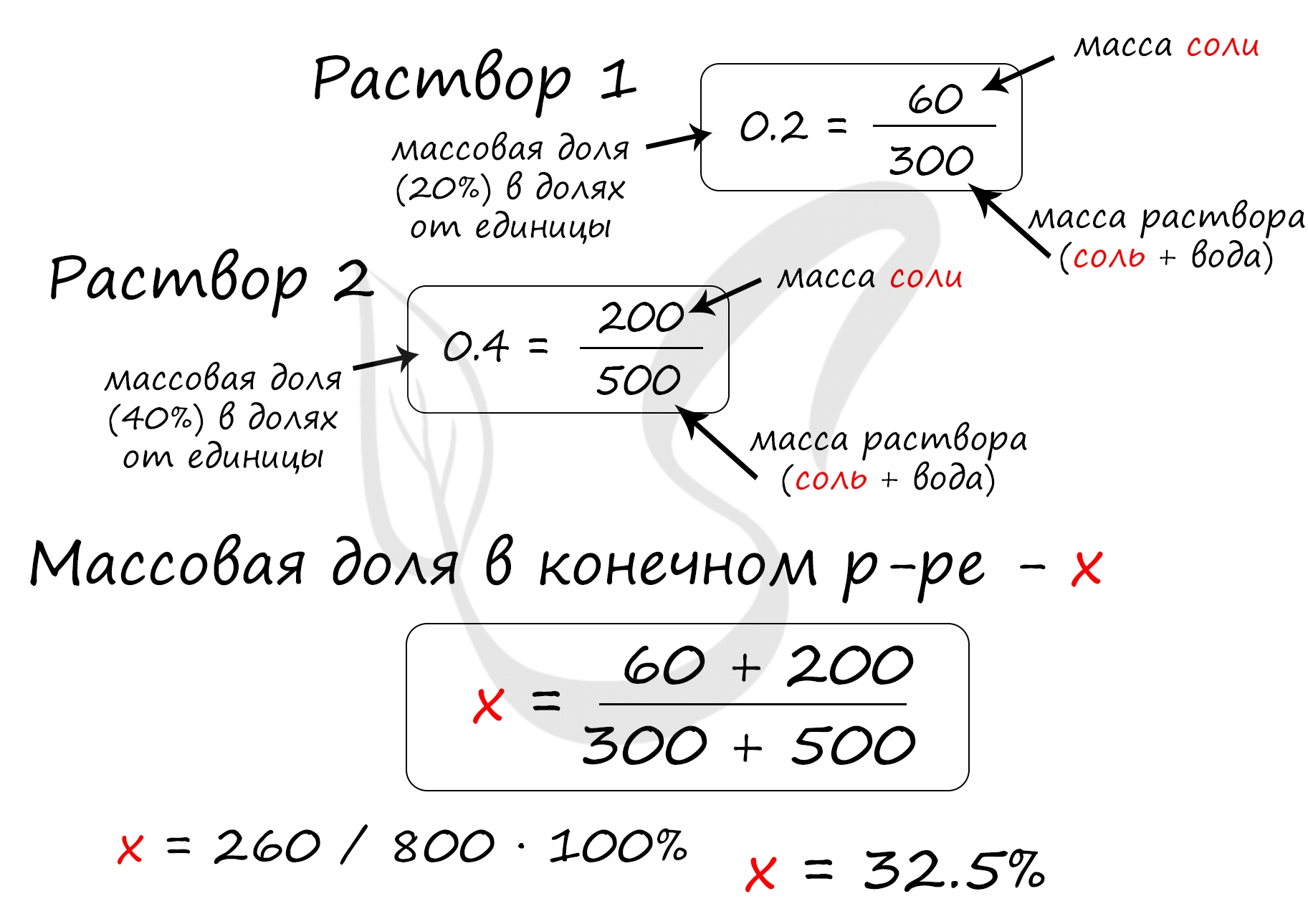
Верный ответ: 32,5
Найдем массу соли, которая присутствует в первом растворе:
m(соли)1 = 300 · 0.2 = 60 грамм
Найдем массу соли, которая присутствует во втором растворе:
m(соли)2 = 500 · 0.4 = 200 грамм
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7613.
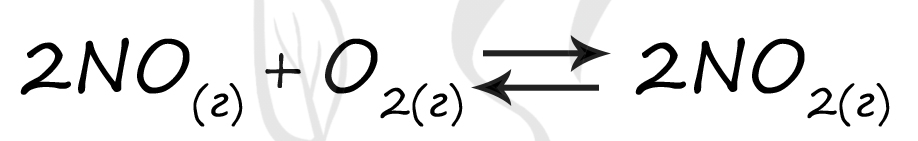
Верный ответ: 35
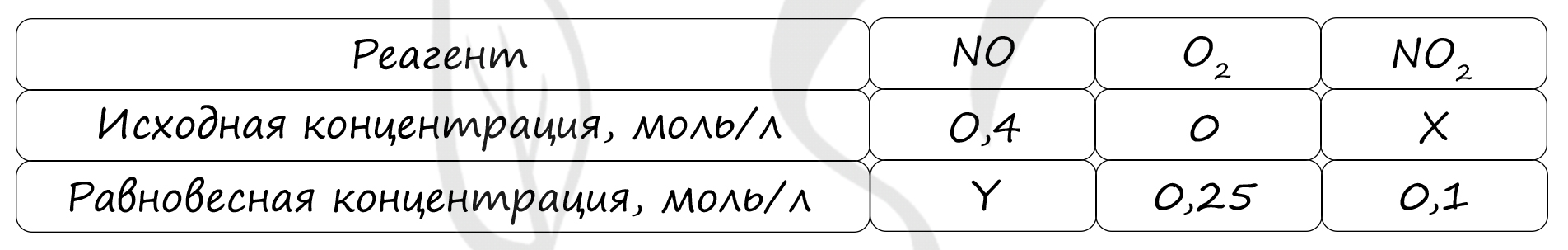
Таблица (по условию)
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7592.