Алюминий
Алюминий является самым распространенным металлом в земной коре. Свойства алюминия позволяют активно применять в составе металлоконструкций: он легкий, мягкий, поддается штамповке, обладает высокой антикоррозийной устойчивостью.
Для алюминия характерна высокая химическая активность, отличается также высокой электро- и теплопроводностью.
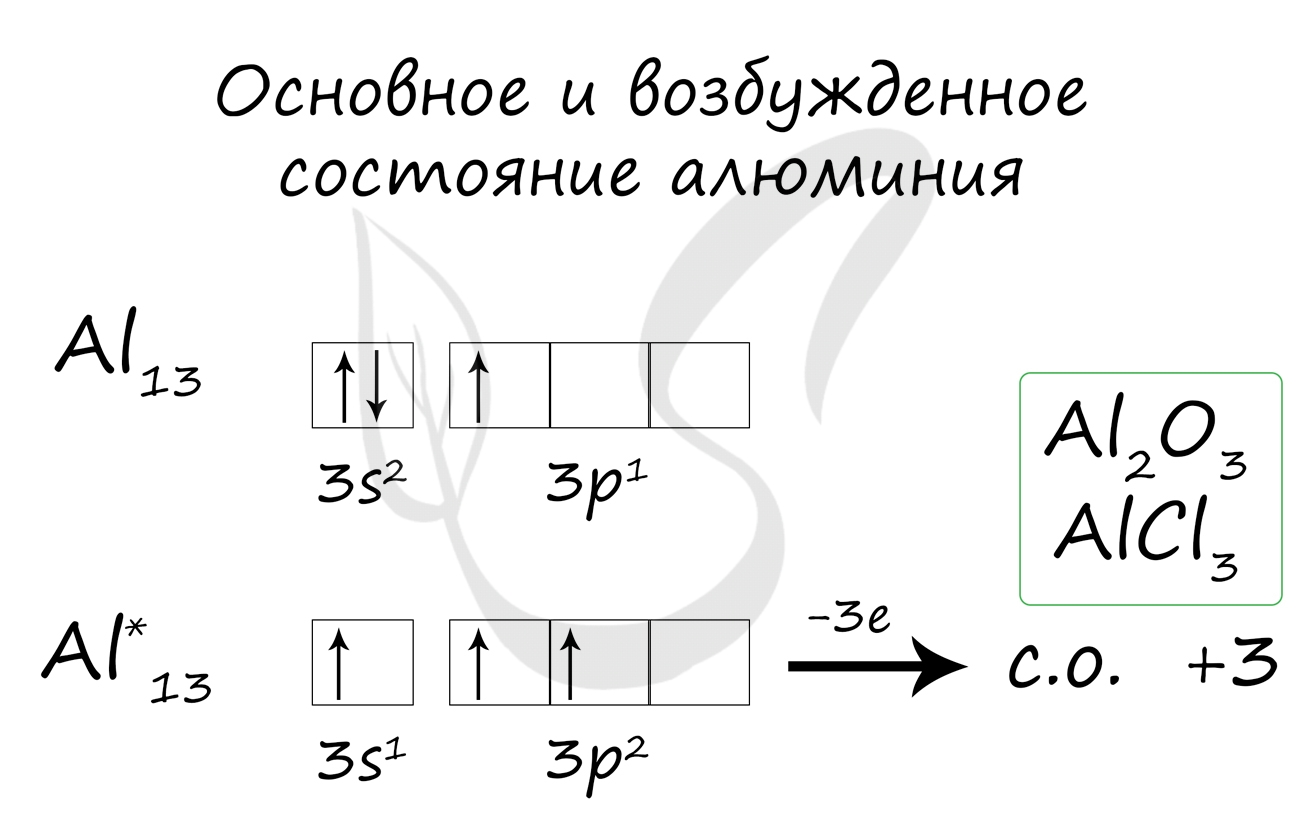
Основное и возбужденное состояние
При переходе атома алюминия в возбужденное состояние 2 электрона s-подуровня распариваются, и один электрон переходит на p-подуровень.
Природные соединения
В природе алюминий встречается в виде минералов:
- Al2O3 - корунд
- 3BeO*Al2O3*6SiO2 - берилл (аквамарин - примесь Fe и изумруд - примесь Cr2O3)
- Al2O3*Cr2O3 - красный рубин
- Al2O3 с примесью Fe+2/Fe+3/Ti
- Al2O3*H2O - боксит
Получение
Алюминий получают путем электролиза расплава Al2O3 в криолите (Na3[AlF6]). Галлий, индий и таллий получают схожим образом - методом электролиза их оксидов и солей.
Al2O3 → (t) Al + O2 (в расплаве криолита - Na3[AlF6])
Химические свойства
- Реакции с неметаллами
- Реакции с кислотами и щелочами
- Реакция с водой
- Алюминотермия
При комнатной температуре реагирует с галогенами (кроме фтора) и кислородом, покрываясь при этом оксидной пленкой.
Al + O2 → Al2O3 (снаружи Al покрыт оксидной пленкой - Al2O3)
Al + Br2 → AlBr3 (бромид алюминия)
При нагревании алюминий вступает в реакции с фтором, серой, азотом и углеродом.
Al + F2 → (t) AlF3 (фторид алюминия)
Al + S → (t) Al2S3 (сульфид алюминия)
Al + N2 → (t) AlN (нитрид алюминия)
Al + C → (t) Al4C3 (карбид алюминия)
Алюминий проявляет амфотерные свойства (греч. ἀμφότεροι - двойственный), вступает в реакции как с кислотами, так и с основаниями.
Al + HCl → AlCl3 + H2
Al + H2SO4(разб.) → Al2(SO4)3 + H2↑
Al + H2SO4(конц.) → (t) Al2(SO4)3 + SO2↑ + H2O
Al + HNO3(разб.) → (t) Al(NO3)3 + N2O + H2O
Al + NaOH + H2O → Na[Al(OH)4] + H2↑ (тетрагидроксоалюминат натрия; поскольку алюминий дан в чистом виде - выделяется водород)
При прокаливании комплексные соли не образуются, так вода испаряется - вместо них образуются (в рамках ЕГЭ) средние соли - алюминаты (академически - сложные окиселы):
Na[Al(OH)4] → (t) NaAlO2 + H2O
При комнатной температуре не идет из-за образования оксидной пленки - Al2O3 - на воздухе. Если разрушить оксидную пленку нагреванием раствора щелочи или амальгамированием (покрытием металла слоем ртути) - реакция идет.
Al + H2O → (t) Al(OH)3 + H2↑
Алюминотермия (лат. Aluminium + греч. therme - тепло) - способ получения металлов и неметаллов, заключающийся в восстановлении их оксидов алюминием. Температуры при этом процессе могут достигать 2400°C.
С помощью алюминотермии получают Fe, Cr, Mn, Ca, Ti, V, W.
Fe2O3 + Al → (t) Al2O3 + Fe
Cr2O3 + Al → (t) Al2O3 + Cr
MnO2 + Al → (t) Al2O3 + Mn
Оксид алюминия
Оксид алюминия получают в ходе взаимодействия с кислородом - на воздухе алюминий покрывается оксидной пленкой. При нагревании гидроксид алюминия, как нерастворимое основание, легко разлагается на оксид и воду.
Al + O2 → Al2O3
Al(OH)3 → (t) Al2O3 + H2O↑
Проявляет амфотерные свойства: реагирует и с кислотами, и с основаниями.
Al2O3 + H2SO4 → Al2(SO4)3 + H2O
Al2O3 + NaOH + H2O → Na[Al(OH)4] (тетрагидроксоалюминат натрия)
Al2O3 + NaOH → (t) NaAlO2 + H2O (алюминат натрия)
Al2O3 + Na2O → (t) NaAlO2
Гидроксид алюминия
Гидроксид алюминия получают в ходе реакций обмена между растворимыми солями алюминия и щелочами. В результате гидролиза солей алюминия часто выпадает белый осадок - гидроксид алюминия.
AlBr3 + LiOH → Al(OH)3↓ + LiBr
Al(NO3)3 + K2CO3 → KNO3 + Al(OH)3↓ + CO2 (двойной гидролиз: Al(NO3)3 гидролизуется по катиону, K2CO3 - по аниону)
Al2S3 + H2O → Al(OH)3↓ + H2S↑
Проявляет амфотерные свойства. Реагирует и с кислотами, и с основаниями. Вследствие нерастворимости гидроксид алюминия не реагирует с солями.
Al(OH)3 + H2SO4 → Al2(SO4)3 + H2O
Al(OH)3 + LiOH → Li[Al(OH)4] (при избытке щелочи будет верным написание - Li3[Al(OH)6] - гексагидроксоалюминат лития)
© Беллевич Юрий Сергеевич 2018-2024
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.