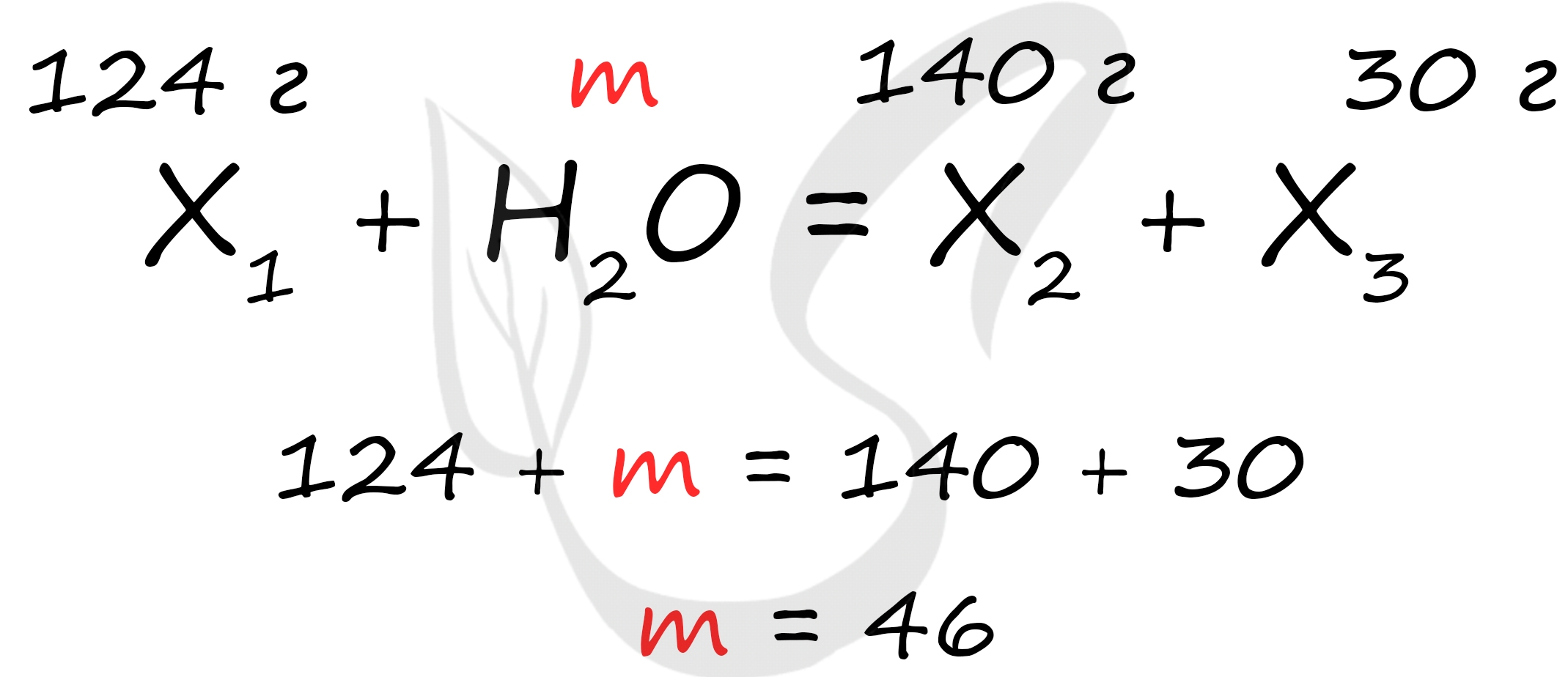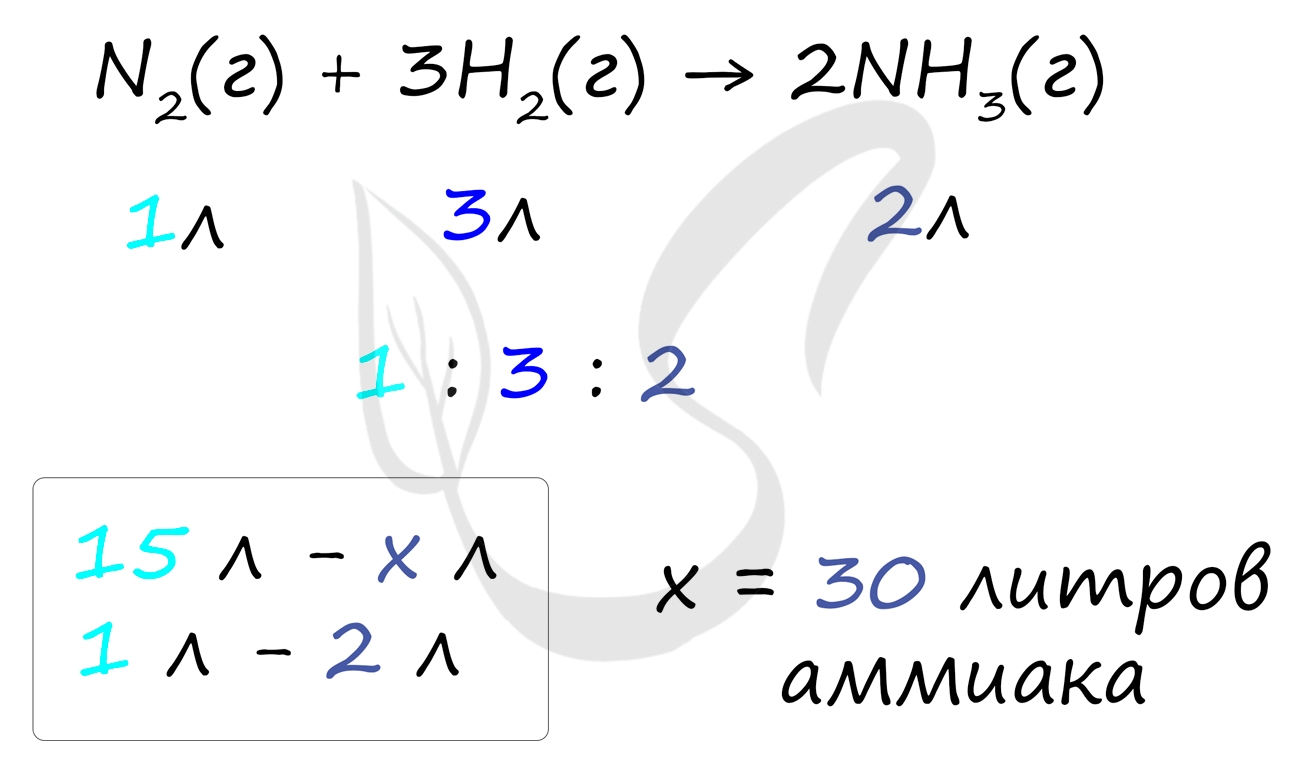Основные законы химии
Законов в химии большое множество. В этой статье собраны и объяснены наиболее важные, для того, чтобы вы понимали основы химии и могли успешно решать задачи.
Вы увидите множество примеров по ходу данной статьи, обратите внимание на то, что все реакции уравнены. Это необходимое условие для решения задач.
Закон сохранения массы веществ
Гласит о том, что масса веществ, вступающих в реакцию, равна массе веществ, образующихся в результате реакции. Бесспорно, данный закон служит фундаментом решения любой химической задачи.
Массы исходных веществ и продуктов всегда будут одинаковы. Если в результате реакции образуется газ, вы можете найти количества вещества газа и посчитать его массу. Этот закон не имеет исключений.
Объем газа легко перевести в массу, например, найдем массу 32 литров кислорода:
ν (O2) = V(O2) : VM = 32 литра : 22.4 литра/моль = 1.43 моль
m (O2) = ν(O2) × M(O2) = 1.43 моль × 32 грамм/моль = 45.76 грамм
Очевидно, что выделение газа не нарушает закон сохранения масс, напротив - является его подтверждением. Моль в химии - замечательный посредник, который помогает переводить литры в граммы, или наоборот.
Иногда, только вспомнив про закон сохранения масс, вы можете найти массу нужного вещества для решения задачи. Представим такое задание:
Неизвестное вещество массой 124 грамма полностью прореагировало с водой, при этом образовалась соль массой 140 грамм и спирт массой 30 грамм. ... здесь много-много текста... Найдите неизвестное вещество.
Это сильно сокращенный пример задания :) Решение это задачи основано на законе сохранения масс. Нам известно все необходимое, чтобы посчитать массу воды.
Посчитав массу воды, в дальнейшем мы найдем количество вещества воды и сможем перейти к остальным веществам в задачке (не пытайтесь ее решить до конца, она составлена мной для примера экспромтом :)
Мне доводилось видеть, как в сложных задачках ученики забывали об этом законе, ведь он кажется таким очевидным и простым. Не забывайте про него, будьте уверены - он вам пригодится ;-)
Закон объемных отношений газов
Установлен Ж. Л. Гей-Люссаком в 1808 году. Закон гласит о том, что при постоянном давлении и температуре объемы газов, вступающих в химическую реакцию, находятся в простых отношениях друг к другу и к объемам газообразных продуктов реакции, то есть отношение объемов, в которых газы участвуют в реакции, соответствует отношению небольших целых чисел.
Попытаемся быть чуть проще в трактовке закона, его суть в том, что объемы вступающих в реакцию газов относятся друг к другу как стехиометрические коэффициенты (простые числа).
Наглядно посмотрим на примеры, которые демонстрируют данный закон:
Объемы газов могут быть не равны между собой, как в реакции выше: 3 газа слева и 2 газа справа. Не существует "закона равности объемов газов", существует только закон сохранения массы, который не противоречит разности объемов газов, наоборот только подтверждает ее, так как данный закон выполняется.
Самостоятельно посчитайте, какое количество аммиака может образоваться при участии 15 литров азота в реакции: N2 + 3H2 = 2NH3. Решение найдете ниже.
Иногда газов в реакции бывает избыточно, и не все они реагирую полностью. Представим следующую задачу: в синтезе аммиака участвовало 10 литров водорода и 20 литров азота. Найдите объем образующегося аммиака и избыток газа, который не вступит в реакцию.
© Беллевич Юрий Сергеевич 2018-2024
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.